
【题目】用NA表示阿伏加德罗常数的数值,下列叙述中不正确的是( )
A.16g氧气中含有的氧原子数目为NA
B.1L0.1mol·L-1Na2CO3溶液中含有的阴离子数目大于0.1NA
C.标准状况下,22.4LCl2中含有的电子数为34NA
D.标准状况下,22.4L乙醇中含有的分子数为NA
【答案】D
【解析】
A.16g氧气的物质的量为![]() =0.5mol,0.5mol氧气中含有1mol氧原子,即氧原子的数目为NA,故A正确;
=0.5mol,0.5mol氧气中含有1mol氧原子,即氧原子的数目为NA,故A正确;
B.常温下,1L0.1molL-1Na2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解:CO32-+H2O![]() HCO3-+OH-,1mol CO32-水解生成2mol离子,导致溶液中阴离子大于0.1mol,溶液中阴离子数目之和大于0.1NA,故B正确;
HCO3-+OH-,1mol CO32-水解生成2mol离子,导致溶液中阴离子大于0.1mol,溶液中阴离子数目之和大于0.1NA,故B正确;
C.氯气是双原子分子,含有的电子数为34,标准状况下,22.4LCl2的物质的量为![]() =1mol,则1mol氯气含有的电子数为34NA,故C正确;
=1mol,则1mol氯气含有的电子数为34NA,故C正确;
D.标准状况下,乙醇为非气态,无法计算22.4L乙醇的物质的量,故D错误;
故选D。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:
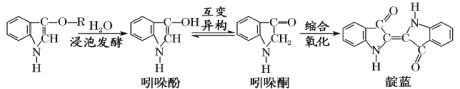
下列说法不正确的是
A.靛蓝的分子式为C16H10N2O2B.浸泡发酵过程发生的反应为取代反应
C.1mol 吲哚酚与H2加成时可消耗4mol H2D.吲哚酚的苯环上的二氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A.酸性强弱:HX>HY>HZ
B.P点对应的溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
C.各溶液在滴定过程中任何时刻,溶液中水的电离一直受抑制
D.HZ的电离方程式为:HZ![]() H++Z-
H++Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
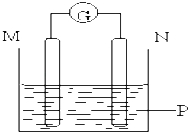
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别是__、__(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)r(Li+)__r(H-),原因是___。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是__。中心原子的杂化形式为___。LiAlH4中,存在__(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图a的BornHaber循环计算得到。
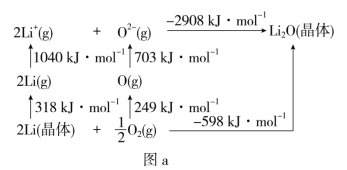
可知,Li原子的第一电离能为__kJ·mol-1,O=O键键能为__kJ·mol-1,Li2O晶格能为__kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图b所示,已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为___g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是_______________________________。
② 氨催化氧化生成一氧化氮反应的化学方程式是_____________________________。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_____________________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为_______mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
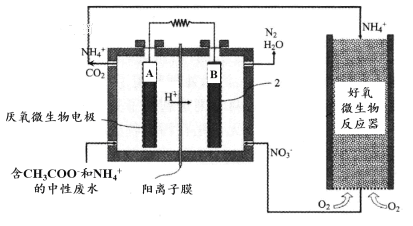
① 已知A、B两极生成CO2和N2,写出A极的电极反应式:______________________。
② 用化学用语简述NH4+去除的原理:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )

A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是

A. NaClO3在发生器中作氧化剂
B. 吸收塔中1mol H2O2得到2mol电子
C. 吸收塔中温度不宜过高,会导致H2O2的分解
D. 从“母液”中可回收的主要物质是Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com