
����Ŀ��I���̵����е�NOx����Ҫ�Ĵ�����Ⱦ��֮һ��Ϊ�˼���京����ѡ�����¼�ⷽ�����ش��������⣺
��vL����ͨ�������ữ��H2O2��Һ�У�ʹNOx��ȫ��������NO3-����ˮϡ����100.00mL����ȡ20.00mL����Һ������v1mLc1mol��L��1 FeSO4����Һ(����)����ַ�Ӧ����c2mol��L��1 K2Cr2O7����Һ�ζ�ʣ���Fe2�����յ�ʱ����v2mL��
��1��NO��H2O2����ΪNO3-�����ӷ���ʽΪ___��
��2����ˮϡ�͵�100.00ml���õIJ�����������Ͳ���ձ�������������ͷ�ι��⣬����Ҫ___���ζ�����ʹ�õIJ���������Ҫ��____��
��3���ζ������з������з�Ӧ��
3Fe2����NO3-��4H��=NO����3Fe3����2H2O
Cr2O72-��6Fe2����14H��=2Cr3����6Fe3����7H2O
��������NOx�ۺϳ�NO2�ĺ���Ϊ___mg/L��
��4�����в�����ʹ�ζ����ƫ�ߵ���____
A.�ζ���δ�ñ�Һ��ϴ
B.��ƿϴ������������ˮ
C.�ζ��ܵζ�ǰ������ȷ���ζ����Ӷ���
D.FeSO4����Һ���ֱ���
II�������£��÷�̪��ָʾ������0.10mol��L��1 NaOH��Һ�ֱ�ζ�20.00mLŨ�Ⱦ�Ϊ0.10mol��L��1�� CH3COOH��Һ��HCN��Һ���õζ�������ͼ��
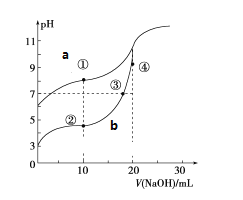
����֪��CH3COOH�� HCN�ĵ���ƽ�ⳣ���ֱ�Ϊ1.75��10-5��6.4��10-10��
��1��ͼ___��a��b����NaOH��Һ�ζ�HCN��Һ��pH�仯�����ߣ��жϵ�������___��
��2�������ʾ��Һ����������Ũ�ȵĴӴ�С��˳��____��
��3����ٺ͵����ʾ��Һ�У�c(CH3COO��)��c(CN��)___c(HCN)��c(CH3COOH)������>��<��=����
��4����ڢۢ���ʾ����Һ��ˮ�ĵ���̶��ɴ�С��˳���ǣ�____��
���𰸡�2NO��3H2O2=2H����2NO3-��2H2O 100mL����ƿ ��ƿ����ʽ�ζ��� ![]() CD a ��CH3COOH�� HCN�ĵ���ƽ�ⳣ����֪��HCN����������CH3COOH��Ũ����ͬ�������ᣬHCN��pH����CH3COOH��pHֵ c(Na��)��c(CH3COO��)��c(H��)��c(OH��) = �ܢۢ�
CD a ��CH3COOH�� HCN�ĵ���ƽ�ⳣ����֪��HCN����������CH3COOH��Ũ����ͬ�������ᣬHCN��pH����CH3COOH��pHֵ c(Na��)��c(CH3COO��)��c(H��)��c(OH��) = �ܢۢ�
��������
I����1��NO�����������������Һ�з���������ԭ��Ӧ���������ˮ��
��2��100.00mL��Һ��ϡ������ʵ������Ҫ����Ϊ��Ͳ���ձ�����������100mL����ƿ����ͷ�ιܣ����ζ�ʵ�������Ҫ�õ�����̨����ʽ�ζ��ܡ���ƿ�ȣ�
��3�����ݵζ�ʣ��Fe2+ʱ�����ĵ�K2Cr2O7�����ʵ�������ʣ��Fe2+��Ȼ�������Fe2+��ʣ��Fe2+������NO3��Ӧ��Fe2+���ʵ�����Ȼ�����100mL��Һ����NO3���������ո��ݵ��غ�����NO2������
��4�����ݵζ������в�����K2Cr2O7������Ӱ����з�����
II����1������ͬŨ�����Ӧ�ĵ���̶�[������ƽ�ⳣ��]���з�����
��2�����ݵ���غ��Լ���Һ�����Խ��з�����
��3��������ʼ����������ʵ����Լ������غ������
��4����������к��������ʵı仯��ˮ�ĵ����Ӱ����з�����
��1��NO�����������������Һ�з���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ��2NO��3H2O2=2H����2NO3-��2H2O��
��2��100.00mL��Һ��ϡ������ʵ������Ҫ����Ϊ��Ͳ���ձ�����������100mL����ƿ����ͷ�ιܣ����ζ�ʵ�������Ҫ�õ�����̨����ʽ�ζ��ܡ���ƿ�����в�������Ϊ��ʽ�ζ��ܡ���ƿ��
��3��������ɷ���ʽ���г���ϵʽ�����¹�ϵʽ���������25mL NO3��Һ���㣩��
![]()
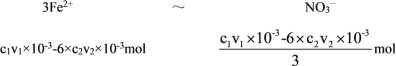
��100mLNO3��Һ��NO3-����Ϊ��![]() ��5mol =
��5mol =![]() mol�����ݵ�Ԫ���غ㣬����������������
mol�����ݵ�Ԫ���غ㣬����������������![]() mol��46g/mol=
mol��46g/mol=![]() g=
g=![]() mg����vL������NOx�ۺϳ�NO2�ĺ���Ϊ
mg����vL������NOx�ۺϳ�NO2�ĺ���Ϊ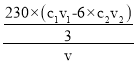 mg/L=
mg/L=![]() mg/L��
mg/L��
��4��A���ζ���δϴ�ӣ�K2Cr2O7������������������ʣ��Fe2+ƫ���¼���Fe2+��NO3��Һ��Ӧ��Fe2+ƫС���Ӷ������NO3��ֵƫС�����½��ƫ�ͣ���A����
B����ƿ����ˮ��Ӱ��ζ�ʵ�飬�Խ����Ӱ�죬��B����
C���ζ��ܵζ�ǰ������ȷ���ζ����Ӷ���������K2Cr2O7����������С����Aͬ��������֪���ƫ��C��ȷ��
D��FeSO4����Һ���ֱ��ʣ����ᵼ�����ĵ�K2Cr2O7ƫС��ͬ����֪���ƫ��D��ȷ��
II���ɶ��ߵĵ���ƽ�ⳣ����֪�����ԣ�CH3COOH >HCN��
��1��Ũ����ͬ�������ᣬHCN��pH����CH3COOH��pHֵ����aΪNaOH��Һ�ζ�HCN��Һ��pH�仯�����ߣ�
��span>2����۴��ڵ��ƽ�⣺c(Na��)+ c(H��)= c(OH��)+ c(CH3COO��)�����ʱ��Һ�����ԣ���c(H��)��c(OH��)���ɵ�c(Na��)��c(CH3COO��)����Na����CH3COO�������H����OH���ߺܶ࣬�ɴ˿�֪��Һ������Ũ�ȴ�С��ϵΪ��c(Na��)��c(CH3COO��)��c(H��)��c(OH��)��
��3������ʼ����������ʵ�����ȣ���c(CH3COO��)+ c(CH3COOH)=c(CN��)+c(HCN)���ɴ˿�֪c(CH3COO��)��c(CN��)=c(HCN)��c(CH3COOH)��
��4���Ӣڡ��ܵĹ����У���Һ��һֱ�ڷ�������кͣ������ˮ�ĵ���̶���С����ˮ�ĵ���̶��ɴ�С��˳���Ǣܢۢڡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ij��Һ����ˮ���������c(H+)��c(OH-)�ij˻�Ϊ1��10-20������˵����ȷ����
A.����Һ��pHһ����10B.����Һ������pH��4
C.����Һ��pH��������7D.��������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���к��Ȳⶨ��ʵ���У��õ��IJ����������ձ����¶ȼơ�_________________��_______
��2��ʵ��ʱ���ձ��������Ӹǰ壬����к���![]() ����ֵ__________
����ֵ__________![]() ����ƫ������ƫС��������Ӱ����
����ƫ������ƫС��������Ӱ����![]() ��
��
��3���ɼס���������ɵ�ʵ��С�飬��ͬ����ʵ�������£���ͬ����ʵ�������ͷ�����������ⶨ�к��ȵ�ʵ�飬ʵ���Լ������������ұ���ʾ��
![]() ���ַ�Ӧ����Һ�ı�����
���ַ�Ӧ����Һ�ı�����![]() ������ʵ�������ı����ݼ���Һ����ı仯����
������ʵ�������ı����ݼ���Һ����ı仯����![]() ____________________��
____________________��![]() ____________________��
____________________��![]() ��֪��Һ�ܶȾ�Ϊ
��֪��Һ�ܶȾ�Ϊ![]()
![]() ԭ����_____________________________________________________________��
ԭ����_____________________________________________________________��
��Ӧ�� | ��ʼ�¶� | �����¶� | �к��� |
A. |
|
|
|
B. |
|
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�

���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������·�����Ӧ��4NO2(g)��O2(g)![]() 2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
2N2O5(g) ��H<0��T1ʱ�������Ϊ2L�ĺ����ܱ�������ͨ��NO2��O2������ʵ�����������ʾ��
ʱ��/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol��L��1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol��L��1) | 1.00 | c1 | c2 | 0.50 |
��1��0��10s��N2O5��ƽ����Ӧ����Ϊ__ �����¶��µ�ƽ�ⳣ��Ϊ___��
��2�������������䣬���������ѹ��һ�룬�����´ﵽƽ��ʱc(N2O5)___2.00mol��L��1������>��<��=������ͬ��
��3�������¶�T1ʱƽ�ⳣ��ΪK1���¶�T2ʱƽ�ⳣ��ΪK2����K1<K2����T1____T2��
��4�����п�����Ϊƽ������ݵ���___
A.�����ڻ���������ɫ���ٸı�
B.����1molO2��ͬʱ����2molN2O5
C.��������ƽ��Ħ���������ٱ仯
D.���������ܶȲ��ٱ仯
��5���ı���Щ��ʩ��������NO2��ƽ��ת����___������������������ϣ�
��6����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ��mol1
2C(s)+O2(g)=2CO(g) ��H=��221.0 kJ��mol1
C(s)+O2(g)=CO2(g) ��H=��393.5 kJ��mol1
������β�������ķ�Ӧ֮һ��2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H=___ kJ��mol1�����ڸ÷�Ӧ�Է����е�������___��ѡ������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
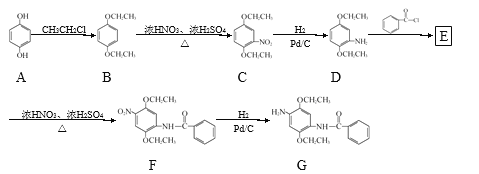
����Ŀ��ij�о�С�����ԶԱ�����Ϊԭ�Ϻϳ�Ⱦ��G���ϳ�·�����£�
![]()
![]() �еĺ�������������Ϊ________��________��
�еĺ�������������Ϊ________��________��
![]() �ķ�Ӧ����Ϊ________��
�ķ�Ӧ����Ϊ________��
![]() �ķ���ʽΪ
�ķ���ʽΪ![]() ��д��E�Ľṹ��ʽ��________��
��д��E�Ľṹ��ʽ��________��
![]() ��һ��ͬ���칹��ͬʱ��������������д����ͬ���칹��Ľṹ��ʽ��___��
��һ��ͬ���칹��ͬʱ��������������д����ͬ���칹��Ľṹ��ʽ��___��
![]() ���б������ҷ�������һ������̼ԭ�ӣ�����
���б������ҷ�������һ������̼ԭ�ӣ�����![]() ��Һ������ɫ��Ӧ��
��Һ������ɫ��Ӧ��![]() �ܷ���ˮ�ⷴӦ��ˮ��������4�ֲ�ͬ����������ˮ�����֮һ��
�ܷ���ˮ�ⷴӦ��ˮ��������4�ֲ�ͬ����������ˮ�����֮һ��![]() �����ᡣ
�����ᡣ
![]() ��֪��
��֪��![]() ����
����![]()
![]()
![]() �ױ�������
�ױ�������![]()
![]()
![]()
![]()
![]() ,���
,���![]() ��
��![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ________�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�ĺϳ�·������ͼ________�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g)+I2(g)![]() 2HI(g) ��H=��a kJ��mol-1��֪������˵����ȷ���ǣ� ��
2HI(g) ��H=��a kJ��mol-1��֪������˵����ȷ���ǣ� ��

A.H2��I2��HI�����еĻ�ѧ�����ǷǼ��Թ��ۼ�
B.��ͬ�����£�1 mol H2(g)��1 mol I2(g)��������С��2 mol HI(g)��������
C.�Ͽ�2 mol HI�����еĻ�ѧ����������ԼΪ(c+b+a)kJ
D.���ܱ������м���2 mol H2(g)��2 mol I2(g)����ַ�Ӧ��ų�������Ϊ2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A���Ʊ�Ѫ�ܽ��������Ƽ�����������ԭ�ϣ���˴Ź�������ͼ����3�����շ壬���շ�������Ϊ![]() ����֪B�Ľṹ��ֻ��һ��������ͼ����BΪ��Ҫԭ�ϵĺϳ�·�ߡ��Իش��������⣺
����֪B�Ľṹ��ֻ��һ��������ͼ����BΪ��Ҫԭ�ϵĺϳ�·�ߡ��Իش��������⣺

(1)![]() ��������________��D���еĹ�����������________��
��������________��D���еĹ�����������________��
(2)д����Ӧ![]() �Ļ�ѧ����ʽ��________���÷�Ӧ�ķ�Ӧ������________����Ӧ
�Ļ�ѧ����ʽ��________���÷�Ӧ�ķ�Ӧ������________����Ӧ![]() �ķ�Ӧ������________��
�ķ�Ӧ������________��
(3)��Ӧ![]() �е��Լ�a�ǣ�________��
�е��Լ�a�ǣ�________��
(4)д��G�Ľṹ��ʽ��________��
(5)![]() ��ͬ���칹���ж��֣��ܷ���ˮ�ⷴӦ����________�֣�д�����м��ܷ���ˮ�ⷴӦ�����ܷ���������Ӧ���л���Ľṹ��ʽ��________��
��ͬ���칹���ж��֣��ܷ���ˮ�ⷴӦ����________�֣�д�����м��ܷ���ˮ�ⷴӦ�����ܷ���������Ӧ���л���Ľṹ��ʽ��________��![]() д��һ�ּ���
д��һ�ּ���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ijЩ�л����ģ��ͼ������Ҫ��ش��������⣺
��� | �� | �� | �� |
ģ�� |
|
|
|
(1)�ķ���ʽ��___________________����һ�ȴ�����___________________�֡�
(2)�����![]() ��
��![]() ��Һ������Ӧ�Ļ�ѧ����ʽ��______________________________________���÷�Ӧ�ķ�Ӧ������___________________��
��Һ������Ӧ�Ļ�ѧ����ʽ��______________________________________���÷�Ӧ�ķ�Ӧ������___________________��
(3)����Ħ������Ϊ![]() �����ñ��Ʊ�������ʱ�Ĵ�����___________________��
�����ñ��Ʊ�������ʱ�Ĵ�����___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com