
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-20,下列说法正确的是
A.该溶液的pH一定是10B.该溶液不可能pH=4
C.该溶液的pH不可能是7D.不会有这样的溶液
【答案】C
【解析】
根据酸或碱抑制水电离,含有弱根离子的盐水解,促进水电离,那么25℃时,纯水中水电离产生的c(H+)×c(OH-)=1×10-14,该溶液中由水电离产生的c(H+)×c(OH-)=1×10-20<1×10-14,说明该溶液中的溶质抑制了水电离,则溶液可能是酸或碱溶液。
A.如果溶液是酸溶液,则溶液中c(OH-)=1×10-10mol/L,c(H+)=![]() mol/L=1×10-4mol/L,则溶液的pH=4,如果溶液是碱溶液,则c(H+)=1×10-10mol/L,则溶液的pH=10,故A错误;
mol/L=1×10-4mol/L,则溶液的pH=4,如果溶液是碱溶液,则c(H+)=1×10-10mol/L,则溶液的pH=10,故A错误;
B.如果溶液是酸溶液,则溶液中c(OH-)=1×10-10mol/L,c(H+)=![]() mol/L=1×10-4mol/L,则溶液的pH=4,故B错误;
mol/L=1×10-4mol/L,则溶液的pH=4,故B错误;
C.通过以上分析知,该溶液为酸性或碱性溶液,溶液的pH不可能是7,故C正确;
D.通过以上分析知,有这样的溶液,故D错误;
答案为C


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-,ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是
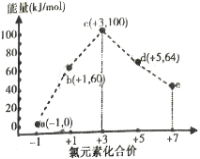
A.e是ClO3-
B.a,b,c,d,e中c最稳定
C.b→a+d反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=-116kJmol-1
D.一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为10:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
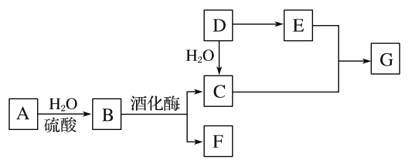
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,下列叙述中正确的是

A.每生成2个AB分子吸收(a-b)kJ热量
B.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)==C(金刚石)△H=+1.90 kJ·mol-1可知,金刚石比石墨稳定
D.500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1500mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 25.60 |
回答下列问题:
(1)实验中,需要润洗的仪器是:________________________(填写仪器名称)。
(2)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是______________
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则消耗盐酸溶液的体积为________mL。
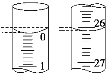
(4)下列操作中会使所测结果偏高的是_________________、偏低的是_________________
①酸式滴定管漏液;②滴定前酸式滴定管尖嘴部分有气泡,滴定过程中气泡变小;③滴定过程中,振荡锥形瓶时,不小心将溶液溅出;④滴定过程中,锥形瓶内加少量蒸馏水; ⑤用甲基橙作指示剂进行滴定时,溶液由橙色变红色时停止滴定;⑥用甲基橙作指示剂,溶液由黄色变橙色,5 s后又变为黄色。⑦读酸式滴定管读数时,滴定前仰视读数
(5)未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.密闭容器中2molSO2和1molO2催化反应后分子数为2NA
B.标准状况下,5.6LCO2气体中含有的氧原子数目为0.5NA
C.1mol重水与1mol水中中子数比为2:1
D.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G在生活中有很多用途,工业上利用有机物A(![]() )来制备,其合成路线如图:
)来制备,其合成路线如图: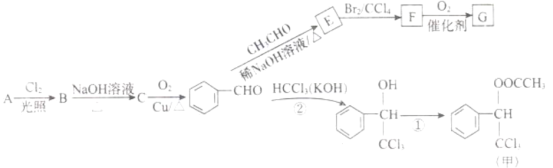
已知:![]()
![]()
![]()
![]() 、
、![]() 代表烃基或氢原子
代表烃基或氢原子![]()
回答下列问题:
(1)C的名称是______,F中官能团的名称是______。
(2)②的反应类型是______,E的结构简式为______。
(3)下列关于E的叙述正确的是______。
A.分子式为![]()
B. 1mol最多能与![]() 发生加成反应
发生加成反应
C. 自身能发生加聚、缩聚反应
D. 最多有9个碳原子位于同一平面
(4)C有多种同分异构体,其中属于芳香族化合物的有______种。
(5)写出反应①的化学方程式______。
(6)F的同分异构体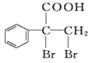 是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线
是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线![]() 其他所需原料自选
其他所需原料自选![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:
将vL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO被H2O2氧化为NO3-的离子方程式为___。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;滴定操作使用的玻璃仪器主要有____。
(3)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NOx折合成NO2的含量为___mg/L。
(4)下列操作会使滴定结果偏高的是____
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4标准溶液部分变质
II、常温下,用酚酞作指示剂,用0.10mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
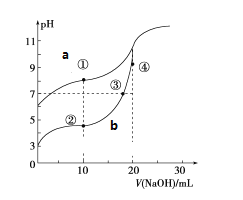
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是___。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:____。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com