
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_________________、_______
(2)实验时大烧杯上若不加盖板,求得中和热![]() 的数值__________
的数值__________![]() 填“偏大”“偏小”或“无影响”
填“偏大”“偏小”或“无影响”![]() 。
。
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如右表所示。
![]() 设充分反应后溶液的比热容
设充分反应后溶液的比热容![]() ,忽略实验仪器的比热容及溶液体积的变化,则
,忽略实验仪器的比热容及溶液体积的变化,则![]() ____________________;
____________________;![]() ____________________。
____________________。![]() 已知溶液密度均为
已知溶液密度均为![]()
![]() 原因是_____________________________________________________________。
原因是_____________________________________________________________。
反应物 | 起始温度 | 终了温度 | 中和热 |
A. |
|
|
|
B. |
|
|
|
【答案】环形玻璃搅拌棒 量筒 偏大 ![]()
![]()
![]() 是强碱,
是强碱,![]() 是弱碱,电离吸热
是弱碱,电离吸热
【解析】
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒;
(2)加盖板会导致热量散失,结合计算公式分析;
(3)![]() 根据
根据![]() 计算;
计算;
②NH3H2O为弱电解质,电离吸热。
![]() 中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒;故答案为:环形玻璃搅拌棒;量筒;
中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒;故答案为:环形玻璃搅拌棒;量筒;
![]() 实验时大烧杯上若不加盖板,热量散失,根据
实验时大烧杯上若不加盖板,热量散失,根据![]() ,温度变化值减小,求得中和热
,温度变化值减小,求得中和热![]() 的数值偏大;故答案为:偏大;
的数值偏大;故答案为:偏大;
![]() 由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如右表所示。
由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如右表所示。![]() 设充分反应后溶液的比热容
设充分反应后溶液的比热容![]() ,忽略实验仪器的比热容及溶液体积的变化,则
,忽略实验仪器的比热容及溶液体积的变化,则![]() ;
;![]() ,故答案为:
,故答案为:![]() ;
; ![]() ;
;
![]() 找
找![]() 的原因先去找差别,可知NaOH是强碱,
的原因先去找差别,可知NaOH是强碱,![]() 是弱碱,电离吸热;故答案为:NaOH是强碱,
是弱碱,电离吸热;故答案为:NaOH是强碱,![]() 是弱碱,电离吸热。
是弱碱,电离吸热。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
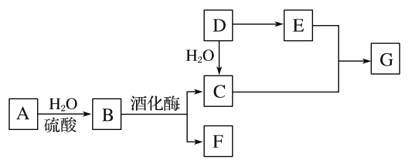
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.密闭容器中2molSO2和1molO2催化反应后分子数为2NA
B.标准状况下,5.6LCO2气体中含有的氧原子数目为0.5NA
C.1mol重水与1mol水中中子数比为2:1
D.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G在生活中有很多用途,工业上利用有机物A(![]() )来制备,其合成路线如图:
)来制备,其合成路线如图: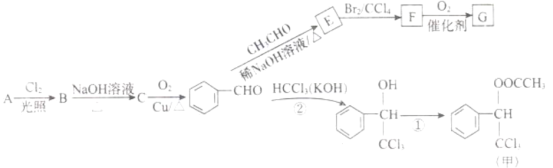
已知:![]()
![]()
![]()
![]() 、
、![]() 代表烃基或氢原子
代表烃基或氢原子![]()
回答下列问题:
(1)C的名称是______,F中官能团的名称是______。
(2)②的反应类型是______,E的结构简式为______。
(3)下列关于E的叙述正确的是______。
A.分子式为![]()
B. 1mol最多能与![]() 发生加成反应
发生加成反应
C. 自身能发生加聚、缩聚反应
D. 最多有9个碳原子位于同一平面
(4)C有多种同分异构体,其中属于芳香族化合物的有______种。
(5)写出反应①的化学方程式______。
(6)F的同分异构体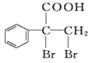 是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线
是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线![]() 其他所需原料自选
其他所需原料自选![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸接触室发生如下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.6 | 1.2 | 1.2 |
n(O2)/mol | 0.36 | 0.36 | 0.72 | |
SO2的平衡转化率 | 80% | α1 | α2 | |
A.甲→乙,平衡向正反应方向移动,α(O2)增大,放出的热量为47.18kJ
B.平衡时,丙中c(SO2)是甲中的2倍
C.平衡时,SO2的转化率:α2>80%>α1
D.该温度下,平衡常数K=400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是降低润滑油凝固点的高分子有机化合物,其结构简式为 ,用石油裂解气合成M的路线如下
,用石油裂解气合成M的路线如下
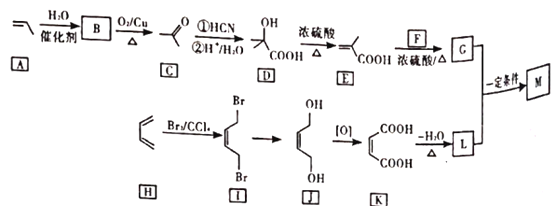
回答下列问题:
(1)B的化学名称为___________。
(2)F的分子式为___________。
(3)G中官能团的名称是___________,G与L在一定条件下生成M的反应类型是___________。
(4)I→J的反应方程式为___________。
(5)写出C的同分异构体的结构简式(核磁共振氢谱为三组峰,峰面积比为3︰2︰1)______。
(6)设计由苯乙烯为起始原料制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一个密闭的玻璃管两端各放一团棉花,再用注射器同时在两端注入适量的浓氨水和浓盐酸,下列说法不正确的是( )
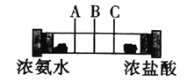
A.玻璃管中发生的反应可表示为:NH3+HCl=NH4Cl
B.用手触摸玻璃管外壁,会感觉到有热量放出
C.实验时会在玻璃管的B处附近看到白雾
D.将浓盐酸换成浓硝酸也会有相似现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:
将vL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO被H2O2氧化为NO3-的离子方程式为___。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;滴定操作使用的玻璃仪器主要有____。
(3)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NOx折合成NO2的含量为___mg/L。
(4)下列操作会使滴定结果偏高的是____
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4标准溶液部分变质
II、常温下,用酚酞作指示剂,用0.10mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
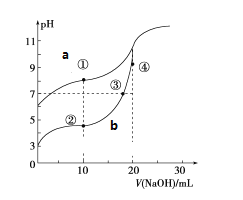
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是___。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:____。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是W、X、Y、Z的气体的单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1mol/Lt溶液与0.1mol/Lu溶液的pH值均为1。下列说法不正确的是( )
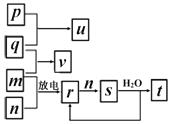
A.Y、W的最高价氧化物对应的水化物均为强酸
B.元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C.p和v恰好反应后的固体产物溶于水后,其溶液中水的电离程度增大
D.v的电子式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com