
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2molL﹣1盐酸
D.提高溶液的温度
科目:高中化学 来源: 题型:
【题目】构成月季和孔雀的主要元素有( )
A. C、H、O、N、P、Fe
B. C、H、O、S、N、P
C. H、O、K、S、P、Mg
D. N、P、K、Ca
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)按要求写出下列反应的化学方程式:
①由饱和FeCl3溶液制备Fe(OH)3胶体_______________________________。
②氢氟酸腐蚀玻璃____________________________________。
(2)按要求写出下列反应的离子方程式:
①制漂白粉(有效成分为次氯酸钙)____________________________________。
②用硫氰化钾溶液检验溶液中含有Fe3+____________________________________。
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至溶液恰呈中性____________________________________;
Ⅱ.已知还原性是I->Fe2+>Br-,1L某溶液中含有FeI2和FeBr2两种溶质,分析知其中Fe2+、I-、Br-的物质的量比为1:1:1。取出1/10体积该混合溶液向其中通入氯气,发现吸收3.36L(标况下)的氯气后溶液中的溶质离子刚好完全被氧化得到I2、Br2、Fe3+。请回答:
①试写出此反应过程中第二步反应的离子方程式__________。
②求原混合溶液中各溶质的物质的量浓度______________。
③当溶液中Br-有一半被氧化时,通入的氯气在标况下所占体积是________升,此时溶液中溶质的物质的量浓度约为(不考虑溴和碘单质的溶解)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是
2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是
A. 单位时间内生成n mol O2的同时生成2n mol NO
B. 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
C. 混合气体的颜色不再改变的状态
D. 混合气体的总质量不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种.
阴离子 | CO32﹣、SiO32﹣、AlO2﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.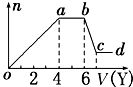
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 , ab段发生反应的离子是 , bc段发生反应的离子方程式为 .
(2)若Y是NaOH溶液,则X中一定含有的阳离子是 , 其物质的量之比为 , ab段反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池的装置如图所示,下列叙述不正确的是( ) 
A.锌片为负极,稀硫酸是电解质溶液
B.电池工作时电子由锌片经导线流向铜片
C.电池工作时铜片逐渐溶解而质量减轻
D.电池工作时实现了化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是
A.原子半径:Na>Si>OB.热稳定性:HF>H2O>NH3
C.碱性:CsOH>KOH>NaOHD.失电子能力:Al>Mg>Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=l.1×10-12以及Ksp[Cu(OH)2] =2×10-20。下列说法错误的是
A. 常温下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度比较:c(AgCl)<c(Ag2CrO4)
B. 常温下,在0.010molL-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度比较:c(AgCl)<c(Ag2CrO4)
C. 某CuSO4溶液里c(Cu2+)=0.02 molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于5
D. 要使0.2molL-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com