
【题目】下列叙述正确的是
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不在2个H原子所连直线的中点处
D. CO2是非极性分子,分子中C原子不在2个O原子所连直线的中点处
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是__,基态镍原子的价电子的电子排布图为__。
(2)C、N、O的第一电离能由大到小的顺序为__。
(3)SO2分子的VSEPR构型为__;SO3分子中心原子的杂化形式为__;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_,分子中的σ键和π键数目之比是__。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键__(填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是__。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为___,属于__晶体。
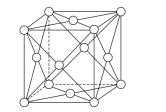
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物X有三种元素组成,某学习小组进行了如下实验:
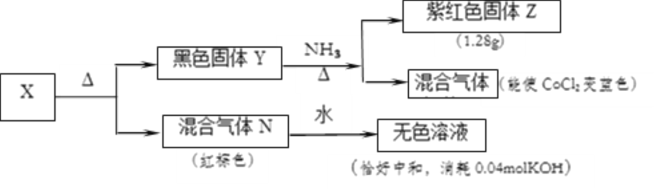
(1)化合物X的化学式为___________
(2)混合气体N通入足量的NaOH溶液中,恰好完全反应生成一种盐,其离子反应方程式为______________。
(3)黑色固体Y与NH3的化学方程式为____________
(4)若以X 3H2O进行实验,在170℃时可以生成一种中间产物W。 0.1mol化合物W能与0.6molHCl刚好完全反应,若0.1mol化合物W再继续加热生成黑色固体Y的质量为32.0g。则化合物W的化学式为______________。
(5)混合气体N有毒,为保护环境,可以用保险粉(Na2S2O4)吸收。请说明混合气体N能用保险粉吸收的理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,在20mL 0.1molL-1一元弱酸HA溶液中滴加同浓度的NaOH溶液,溶液中![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是
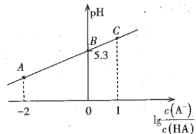
A.室温时,电离常数Ka(HA)=1.0×10-5.3
B.B点对应NaOH溶液的体积是10mL
C.A点溶液中:c(Na+)> c(A-)> c(H+)> c(OH-)
D.从A点到C点的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
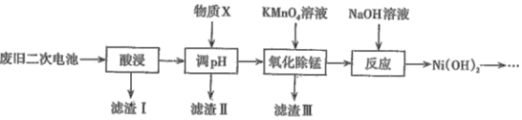
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出重要贡献的科学家。利用废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]合成电池级Ni(OH)2的工艺流程如下:
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(室温下) | 4.0×10-38 | 1.0×10-33 | 1.6×10-14 | 2.0×10-13 |
(1)①已知“酸浸”后滤液中含有:Ni2+、Al3+、Fe3+、Mn2+,调节溶液的pH约为5,其目的是__;以下最适合作为物质X的是____(填字母)。
A.双氧水 B.氨水 C.盐酸 D.NiO
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀:___ 。
(2)滤渣Ⅲ的主要成分是____,“氧化除锰”过程发生反应的离子方程式为______。
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2(镍酸锂),该反应的化学方程式为___________。
(4)镍酸锂是一种有较好前景的锂离子电池正极材料。该电池在充放电过程中,发生LiNiO2和Li1-xNiO2之间的转化,充电时LiNiO2在_______(填“阴”或“阳“)极发生反应,该电极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的己烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.2.8g 的聚乙烯中含有的碳原子数为0.2 NA
D.1mol 乙醇中含有碳氢键的数目为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状态下,两种气态烷烃混合物的密度是1.16g·L-1,该混合物中两种气态烷烃的体积比不可能的是( )
A.2∶5B.1∶5C.9∶5D.16∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吊白块(NaHSO2·HCHO·2H2O)可用作印染工业的还原剂、橡胶合成及制糖工业中的漂白剂。以SO2、纯碱、Zn及甲醛为原料生产吊白块及氧化锌的工艺流程如图:
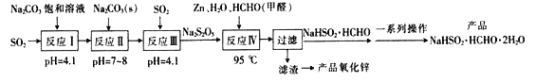
已知:吊白块呈白色块状固体成结晶性粉状,易溶于水,微溶于乙醇,常温时较为稳定,高温下下具有强还原性:120℃以上会分解产生甲醛、二氧化硫和硫化氢等有毒气体。
回答下列问题:
(1)“反应Ⅰ”发生后溶液的pH=4.1,则反应I的产物是__。
(2)设计反应Ⅱ后向反应Ⅲ中继续通入SO2的目的是得到NaHSO3过饱和溶液,从而生成Na2S2O5,则反应Ⅲ中发生反应的化学方程式为__。
(3)“反应Ⅳ”加热的方式最好选用__(填“直接加热”或“水浴加热”);其反应的化学方程式为__。
(4)“过滤”得到的滤液蒸发浓缩时不能在敞口容器中进行,原因是__;洗涤时中的洗涤剂最好选择__(填字母序号)。
A.水 B.无水乙醇 C.稀氢氧化钠溶液
(5)由“滤渣”制备氧化锌的方法是__。
(6)一种测定吊白块中硫的质量分数的方法如下:称取ag产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为bg。则产品中硫的质量分数为__(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
回答下列问题:
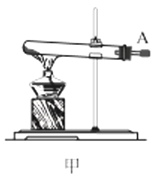
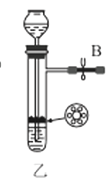

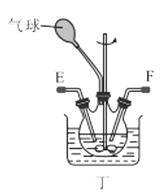
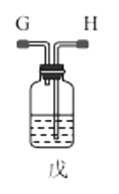
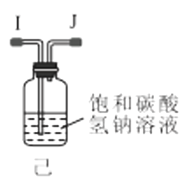
(1)利用装置甲制备氨气的化学方程式为__。
(2)简述检查装置乙气密性的操作__。
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→__→__→EF←__←A。
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为__(填“热水浴”或“冷水浴”);丁中气球的作用是__。
(5)从装置丁的混合物中分离出产品的方法是__(填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为__(已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com