
【题目】如图所示为二维平面晶体示意图,所表示的化学式为AX3的是( )
A.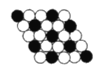 B.
B.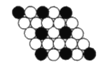 C.
C. D.
D.
【答案】B
【解析】
A. 由图可知,每个白色小球被3个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为3:6=1:2,化学式为AX2,故A错误;
B. 由图可知,每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为2:6,化学式为AX3,故A正确;
C. 由图可知,每个白色小球被4个黑色小球共用,每个黑色小球被4个白色小球共用,则黑色小球和白色小球个数之比为4:4,化学式为AX,故C错误;
D. 由图可知,每个白色小球被6个黑色小球共用,每个黑色小球被3个白色小球共用,则黑色小球和白色小球个数之比为6:3=2:1,化学式为A2X,故D错误;
故选B。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为________,其离子结构示意图为:_______。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为___。
(3)关于C、D 两种元素说法正确的是__________(填序号)。
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为______。
(5)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(6)比较Y元素与其同族短周期元素的氢化物的熔沸点高低__ >___ (填氢化物化学式),理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、物质变化观念是化学学科核心素养之一。已知a、b、c、d、e五种物质的相互转化关系如图所示,其中a、d、e为常见的单质,b、c为化合物。
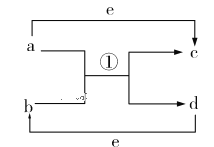
(1)若a、d为短周期非金属单质,且a、d所含元素同主族,a、e所含元素在不同周期。则b、c的沸点:b_________c(填“<”“>”或“=”);a和b反应生成两种氧化物的化学方程式为_________________。
(2)若a是常见的金属单质,点燃发出耀眼白光。d为固态非金属单质,熔点很高,其某种形态单质硬度极大,e为常见的气体单质,则a和b反应的化学方程式为________________________________。
(3)若a、d为常见的金属单质,它们与浓硝酸在加热条件下才能顺利反应。a既可以与强酸反应也可以与强碱反应,d在e中燃烧可以生成b。则足量的d与稀硝酸反应的离子方程式为__________________________________________。
Ⅱ、HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(4)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2)则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填字母)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(5)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
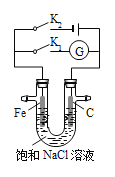
A.K1闭合,K2打开,铁棒上发生的反应为2Cl2e== Cl2↑
B.K1闭合,K2打开,石墨棒周围溶液pH逐渐减小
C.K1打开,K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K1打开,K2闭合,电路中通过0.002 mol电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
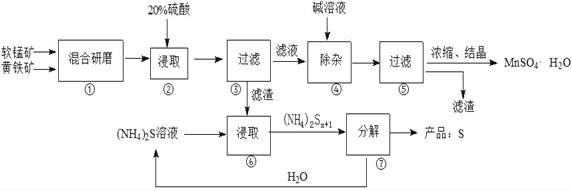
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铜粉与下列试剂的反应,在试管中加入一定量铜粉,加入试剂后,立即塞上橡胶塞,实验现象如下表所示,下列推断不正确的是( )
资料:Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
[Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
装置 | 序号 | 试剂 | 现象 |
| ① | 10 mL浓NH3·H2O,3 mLH2O | 溶液变为绛蓝色,左侧水柱上升 |
② | 10 mL浓NH3·H2O,3 mL H2O2 | 溶液变为绛蓝色,且比①深 | |
③ | 10 mL 20% HNO3溶液,3 mL H2O | 溶液快速变蓝,产生无色气体,左侧水柱下降 | |
④ | 10 mL 20% HNO3溶液,3 mL H2O2 | 溶液变蓝比③慢,产生无色气体,左侧水柱下降 |
A.①中实验现象说明O2参与了反应
B.②中溶液颜色比①深可能是由于H2O2氧化Cu生成Cu2+
C.③中左侧水柱下降可能是反应产生NO气体导致的
D.④比③变蓝慢是由于H2O2分解造成自身消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生反应:C(s)+H2O(g)![]() CO(g)+H2(g)+131.5kJ,5min后达到平衡,固体减少了24g,则
CO(g)+H2(g)+131.5kJ,5min后达到平衡,固体减少了24g,则
A.ρ气体不变时反应达到平衡状态B.v正(CO)为2.4mol/(Lmin)
C.若容器体积缩小,平衡常数减小D.增大C的量,平衡右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应:I2(g)+H2(g)![]() 2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 反应速率 |
(1) | 升高温度 | ______ |
(2) | 加入正催化剂 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 将容器的容积扩大到原来的2倍 | ______ |
(5) | 保持容积不变,通入b mol Ne | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是

A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com