
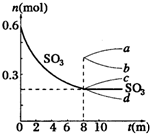
 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:| △c |
| △t |
| ||
| △t |
| [SO2]2?[O2] |
| [SO3]2 |
| [SO2]2?[O2] |
| [SO3]2 |
| ||
| △t |
| ||
| 8min |
| 1 |
| 2 |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
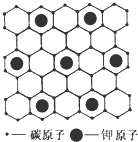 石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )
石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )| A、4 | B、6 | C、8 | D、12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
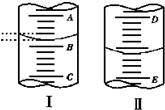 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )| A、Ⅰ中是3.2 mL,Ⅱ中是3.40 mL |
| B、Ⅰ中是4.8 mL,Ⅱ中是3.40 mL |
| C、Ⅰ中是3.2 mL,Ⅱ中是4.60 mL |
| D、Ⅰ中是4.8 mL,Ⅱ中是4.60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5 mo1 |
| B、2.5 mo1 |
| C、3 mo1 |
| D、2 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、36L | B、22.4L |
| C、28L | D、11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制的氯水中只含有Cl2和H2O分子 |
| B、新制的氯水可使蓝色石蕊试纸先变蓝后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后,pH值变小,漂白能力变弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com