
����Ŀ����ͼ��ʾ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨�ϵļ�¼���£���Ƭ�������������ǣ� ��

��Cu������Zn����
��Cu���������ݲ�����������ԭ��Ӧ
��SO42-��Cu���ƶ�
������0.5mol�����������ߣ���ɲ���0.25mol����
�ݵ��ӵ������ǣ�Cu��Zn
��������Ӧʽ��Cu+2e-=Cu2+������������Ӧ��
A.�٢ڢ�B.�ڢܢ�C.�ۢܢ�D.�ڢ�
���𰸡�D
��������
Zn-Cuԭ����У�Zn ��������Cu��������������ط�ӦZn+2H+=Zn2++H2���������ɸ��������������������������ƶ����ݴ˷������н��
��Zn����ʧ����Ϊ������CuΪ�������ٴ���
��Cu���������ӵõ��ӷ�����ԭ��Ӧ������Cu�������ݲ���������ȷ��
����Һ�����������ƶ�����SO42-��Zn���ƶ����۴���
��CuΪ�����������Ϸ�����Ӧ2H++2e-=H2������0.5mol�����������ߣ���ɲ���0.25mol���壬����ȷ��
�ݵ����ɸ������������������ӵ������ǣ�Zn��Cu���ݴ���
��CuΪ�����������Ϸ�����Ӧ2H++2e-=H2�����õ������ǻ�ԭ��Ӧ������
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ɷ������·�Ӧ��P4+5O2=P4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P��P akJ��mol��1��P��O bkJ��mol��1��P="O" ckJ��mol��1��O="O " dkJ��mol��1��

����ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ����H��������ȷ���ǣ� ��
A. ��6a+5d��4c��12b��kJ��mol��1B��4c+12b��6a��5d��kJ��mol��1 B. ��4c+12b��4a��5d��kJ��mol��1
C. ��4a+5d��4c��12b��kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϩ������װ���ϵ����ԭ�ϣ�ʧ��ʱ������ϩ�ڲ�ͬ���¶��£�����һϵ�и��ӵĻ�ѧ�仯�����������к����壬����̴������£�

����˵������ȷ����
A. ������ϩ�ĵ��������ϩ��HCl�ӳɶ���
B. ������Ӧ�Т�������ȥ��Ӧ�������ڣ����⣩������Ӧ
C. �������ɾ�����ϩ�������к������к�HCl��CO��C6H6��
D. �ڻ����ֳ���������ʪë����ס�ڱǣ�������������Զ���ֳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(14��)��������װ��������ʵ��ɹ�ѡ��

��.ʵ�����ü״����������õ���ȩ������֤��ȩ�����ʡ���ش��������⣺
��1��Ӧѡ���װ����___ _____(��д���)��
��2������Ӳ�ʲ�������װ��ͭ�ۣ���д��Ӳ�ʲ������з�����Ӧ�Ļ�ѧ����ʽ___________________
��3��ʵ������۲쵽��ˮ��ɫ��Ϊ������һ����ijѧϰС���ͬѧ������ֲ��룺
A. �����˼ӳɷ�Ӧ�� B. ������������Ӧ��
Ϊ̽�����ֲ�����ȷ��ѧϰС���ͬѧ��pH�Ʋ���ˮ��ɫǰ����Һ��pH�������Һ��pH�½�������Ϊ�������ַ�Ӧ����˵���������________________ ��
��.��ѡ��٢ۢ���֤��ϩ��������Ӧ�����ش��������⣺
��4��д��ʵ��������ϩ�Ļ�ѧ����ʽ_______________________________________��
��5��NaOH��Һ�������ǣ������㼴�ɣ�____________��_ ��
��6��ʵ������У����֢�����ˮ��ɫ�����û�ѧ����ʽ��ʾ��ˮ��ɫ��ԭ��______________��
��7������ʲô�����˵����ϩ��������Ӧ���������� _____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1 g������ȫȼ������ˮ����ʱ�ų�����121 kJ����������1 mol O=O����ȫ����ʱ��������496 kJ��ˮ������1mol H-O���γ�ʱ�ų�����463 kJ����������1mol H-H������ʱ��������Ϊ
A.920 kJB.557 kJC.436 kJD.188 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�������Һ������Ũ�ȹ�ϵʽ��ȷ����
A. pH=5��H2S��Һ�У�c(H+)= c(HS��)=1��10��5mol��L��1
B. pH=a�İ�ˮ��Һ��ϡ��10������pH=b����a=b+1
C. pH=2��H2C2O4��Һ��pH=12��NaOH��Һ���������ϣ�c(Na��)+ c(H��)= c(OH��)+c( HC2O4��)
D. pH��ͬ����CH3COO Na��NaHCO3��NaClO������Һ��c(Na��)������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����������õ�������ѧ���ʣ����㷺Ӧ�������������С��Ӻ��ܷ���(��CoO��Co2O3������Al��Li��)����ȡ��CoCl2��6H2O������������ʾ��
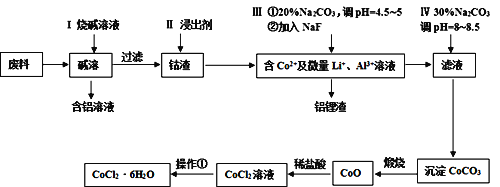
��ش��������⣺
(1)����I����Ҫ�����Ļ�ѧ��Ӧ����ʽΪ______��
(2)��֪Co2O3����ǿ�����ԣ�������II�н�����Ϊ���ᣬ��ɵĺ����_______��
(3)�������Тٵ�Ŀ���dz�ȥAl3+��д���ò���Ӧ�����ӷ���ʽ______��
(4)����ʵ��������CoCO3������Ĺ��������������ƾ��ƺͲ������⣬����______��______(����������)��
(5)����������HCl��Χ�н��еģ��䲽����______��_____�����ˡ�ϴ�ӡ����ϴ�ӹ����п����ù�ҵ�ƾ�����ˮ�����ŵ���_____��
(6)ijͬѧ�ñ���������Һ�ζ�δ֪Ũ�ȵ�CoCl2��Һ�����п���Ϊָʾ������____(��ѡ������������ӵ���ɫ����)
A��KCl B��KSCN C��K2CrO4 D��K2S
��֪����������20��ʱ����ɫ��Kspֵ���±�
��ѧʽ | AgCl | AgSCN | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ |
Ksp | 2.0��10-10 | 1.0��10-12 | 2.0��10-48 | 2.0��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������������������ѧ�����ķǽ���Ԫ�أ������ӿ�����������ɵ�SCN����CN����F�����γɺܶ������
��1����̬Feԭ���У�����ռ�ݵ�����ܲ����Ϊ____�����ܲ���е�ԭ�ӹ����Ϊ_____,������Ϊ______��
��2����֪��CN��2��ֱ���ͷ��ӣ����жԳ��ԣ���CN��2�Цм��ͦҼ��ĸ�����Ϊ______���������Fe��SCN��2+�У��ṩ�չ�����ܹ¶Ե��ӵ�����______��
��3�������K4[Fe��CN��6]�в����ڵ�������_______������ţ���
A�����ۼ� B�����Ӽ� C���Ǽ��Լ� D����λ��
��4��д��һ����SCN����Ϊ�ȵ�����ķ���_________���û�ѧʽ��ʾ�����÷��ӵĿռ乹��Ϊ___________________��
��5����(N2H4)���������ȼ�ϣ�ȼ��ʱ�����ķ�Ӧ�ǣ�N2O4(l)��2N2H4(l)=3N2(g)��4H2O(g)��H=-1038.7kJ��mol-1�����÷�Ӧ����4mol N-H�����ѣ����γɵĦм���________mol��
��6��ͼ1��ʾij�ֺ����л�������Ľṹ���������4����ԭ�ӷֱ�λ�����������4�����㣨��ͼ2���������ڴ��ڿ�ǻ����Ƕ��ij���ӻ���Ӳ��γ�4���������ʶ��

���з��ӻ������У��ܱ����л�������ʶ�����_________�����ţ���
a. CF4 b. CH4 c. NH4�� d. H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ������������������B�ĵ����ڳ�����Ϊ˫ԭ�ӷ��ӣ�����A�ĵ��ʿ��γ���̬����X��X��ˮ��Һ�ʼ��ԣ�D�ļ���������X������ͬ����������D��ͬ����Ԫ����ԭ�Ӱ뾶����Ԫ�أ�EԪ�ص�ԭ�������ȴ�������������ӣ�C��F����Ԫ�ص�ԭ������㹲��13�����ӡ���
��1��X�Ļ�ѧ����Ϊ__________��
��2��B���ʵĽṹʽΪ__________��E����̬�⻯��ĵ���ʽΪ__________��C��D�γɵ����ֻ������У�����һ�����ʺ����������͵Ļ�ѧ�����ֱ�Ϊ______________������������______________(�������ӻ��������������ۻ�������)��
��3��B��C��E�ֱ���A�γɵĻ����������ȶ�����__________(д��ѧʽ)��
��4��D��ͬ���ڼ������������Ӱ뾶��__________(������������С��)��Ԫ�ء�
��5��F�ĵ����ڷ�Ӧ�г���________��(����������������ԭ��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com