
【题目】根据分子结构与性质相关知识,回答下列问题:
(1)NH3分子的VSEPR模型为______________;SO2分子的立体构型为:_______________;
(2)根据等电子原理,写出CN-的电子式_______;SCN-中心原子的杂化方式为 ________;
(3)向CuSO4溶液中逐渐滴加氨水至过量,现象为:__________________________;写出该过程中依次发生的反应离子方程式:_________________________,并写出[Cu(NH3)4]2+的结构简式________。
【答案】四面体形V形![]() sp先生成蓝色絮状沉淀,继续滴加沉淀溶解得深蓝色溶液Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-
sp先生成蓝色絮状沉淀,继续滴加沉淀溶解得深蓝色溶液Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-
【解析】
(1)NH3中心原子N有3个σ键,孤电子对数为(5-3)/2=1,价层电子对数为4,VSEPR模型为四面体形;SO2中性原子S有2个σ键,孤电子对数为![]() =1,价层电子对数为3,空间构型为V形;(2)与CN-等电子体的是N2,根据N2的电子式,推出CN-的电子式为
=1,价层电子对数为3,空间构型为V形;(2)与CN-等电子体的是N2,根据N2的电子式,推出CN-的电子式为![]() ;与SCN-等电子体的是CO2,中心原子的杂化类型为sp;(3)CuSO4溶液中滴加氨水至过量,发生的离子反应方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-,现象是先有蓝色沉淀产生,继续滴加蓝色沉淀消失,溶液变为深蓝色溶液;Cu2+与NH3之间以配位键的结合,即结构简式为
;与SCN-等电子体的是CO2,中心原子的杂化类型为sp;(3)CuSO4溶液中滴加氨水至过量,发生的离子反应方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2+ +2OH-,现象是先有蓝色沉淀产生,继续滴加蓝色沉淀消失,溶液变为深蓝色溶液;Cu2+与NH3之间以配位键的结合,即结构简式为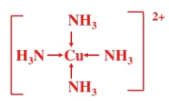 。
。


科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的H2SO4恰好完全反应。B单质与D单质反应后可形成离子化合物BD2;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)B元素的名称________。
(2)形成化合物A2E2的化学键类型是:____________________________。
(3)用电子式表示化合物BD2的形成过程。____________________________。
(4)A的氢氧化物的水溶液和C单质发生反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的![]() 和I-的混合溶液中,反应
和I-的混合溶液中,反应![]() 的分解机理及反应进程中的能量变化如下:
的分解机理及反应进程中的能量变化如下:

步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:![]()
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. 该反应为吸热反应
C. v(![]() )=v(I-)=v(I2)
)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛-铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的外围电子排布式为_____。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要________(填“高”、“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯二甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有_______个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为__________。
③H、C、N、O四元素,其电负性从大到小的顺序依次为___________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与![]() 空间构型相同的一种阳离子:________(填离子符号)。
空间构型相同的一种阳离子:________(填离子符号)。
(4)已知单质钒的晶胞如上图5所示,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为__________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下和一定体积下,可逆反应A2(g)+3B2(g) ![]() 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A. 容器内每减少1mol A2,同时生成2mol AB3
B. 2v 正(B2)=3 v逆 (AB3)
C. 容器内A2、B2、AB3的物质的量之比为1:3:2
D. 容器内气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为( )
A.0.15mol/LB.0.20 mol/LC.0.35 mol/LD.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B. 产物的平均摩尔质量为24g/mol
C. 若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3
D. 反应中消耗的氧气为56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一定浓度的某溶液由水电离出的c(OH﹣)=10﹣4 mol/L,则该溶液的溶质可能是( )
A.AlCl3B.NaOHC.Na2CO3D.NaHSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com