
【题目】在含Fe3+的![]() 和I-的混合溶液中,反应
和I-的混合溶液中,反应![]() 的分解机理及反应进程中的能量变化如下:
的分解机理及反应进程中的能量变化如下:

步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:![]()
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. 该反应为吸热反应
C. v(![]() )=v(I-)=v(I2)
)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和![]() 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
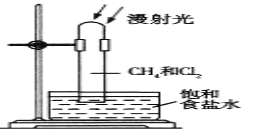
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列日常生活中涉及到一些化学知识分析正确的是
A.铝在空气中耐腐蚀,所以铝是不活泼金属
B.大力开发化石能源以推动经济发展
C.积极推广共享单车以减少雾霾和光化学烟雾
D.焰火的五彩缤纷是某些金属元素化学性质的呈现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
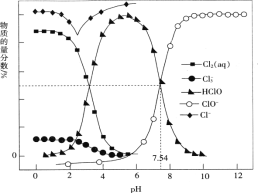
A. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
B. 常温下反应Cl2(aq)+Cl-(aq)![]()
![]() (aq)的K=0.191,当pH增大时,K减小
(aq)的K=0.191,当pH增大时,K减小
C. pH=1的氯水中,c(Cl2)>c(![]() )>c(HClO)>c(ClO-)
)>c(HClO)>c(ClO-)
D. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa=-7.54
H++ClO-的电离常数Ka的对值lgKa=-7.54
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的离子组是
A.Ag+、NO3–、Cl–B.Na+、Fe3+、NO3–
C.K+、Cl–、HCO3–D.Mg2+、Cl–、SO42–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据分子结构与性质相关知识,回答下列问题:
(1)NH3分子的VSEPR模型为______________;SO2分子的立体构型为:_______________;
(2)根据等电子原理,写出CN-的电子式_______;SCN-中心原子的杂化方式为 ________;
(3)向CuSO4溶液中逐渐滴加氨水至过量,现象为:__________________________;写出该过程中依次发生的反应离子方程式:_________________________,并写出[Cu(NH3)4]2+的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是( )
A. 用蒸馏的方法制取蒸馏水
B. 用过滤的方法除去NaCl溶液中含有的少量Na2SO4
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com