
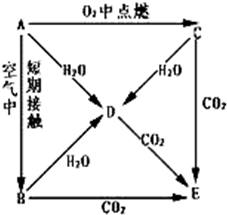
 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.| O2 |
| H2O |
| H2O |
| CO2 |
| CO2 |
| O2 |
| H2O |
| H2O |
| CO2 |
| CO2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、在铁柱上铆上一些锌片 |
| B、制造铁柱时,向铁中渗入一定比例的铜制成合金 |
| C、在铁柱表面涂上一层较厚的沥青 |
| D、在铁柱表面镀锡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若生成1 mol Fe,则吸收的热量小于akJ |
| B、若要提高CO的转化率,则应该加入适当的过量Fe0 |
| C、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D、达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
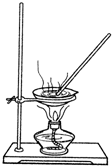 某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃.
某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3He与4He具有相同的中子数 |
| B、3He与4He具有相同的质子数 |
| C、3He与4He具有相同的最外层电子数 |
| D、3He与4He具有不同的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕:c(KOH) |
| B、相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比 |
| C、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| D、液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化 |
| B、合成氨工业上,采用高压以提高NH3的产率 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用S制备H2SO4 |
| B、炼铁时用CaO除去原料中的SiO2 |
| C、将海水中的MgSO4转变为金属Mg |
| D、用NO2生产HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com