
| A、相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕:c(KOH) |
| B、相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比 |
| C、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| D、液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |


科目:高中化学 来源: 题型:
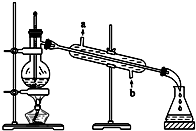 甘油的分离
甘油的分离查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
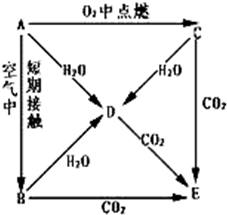 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl的水溶液显酸性,则NH3的水溶液也显酸性 |
| B、常温下铝投入浓硫酸、浓硝酸中都没有气泡产生,则常温下铝投入浓盐酸中也没有气泡产生 |
| C、常温下铝易与氧气反应,则常温下镁也易与氧气反应 |
| D、氧化镁不能溶解在氢氧化钠溶液中,则氧化铝也不能溶解在氢氧化钠溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体 | 硫酸具有还原性 |
| C | AgI沉淀中滴入稀KCl溶液,有白色沉淀出现 | AgCl比AgI更难溶 |
| D | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴下面的氧气含量比液滴边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴下面的氧气含量比液滴边缘少.下列说法正确的是( )| A、(a)区腐蚀比(b)区腐蚀严重 |
| B、该过程发生了化学反应:4Fe+3O2→2Fe2O3 |
| C、该过程是析氢腐蚀,负极反应为:Fe-2e-→Fe2+ |
| D、该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32克O2所含的原子数目为2NA |
| B、0.5molSO2含有的原子数目为1.5NA |
| C、0.5molSO2含有的分子数目为1.5NA |
| D、0.5NA个氯气分子(标况下)的体积是11.2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com