


科目:高中化学 来源: 题型:
| A、NO2可与水反应 |
| B、Al(OH)3是既能与强酸反应又能与强碱反应,是两性氢氧化物 |
| C、金属钠投入硫酸铜溶液中可置换出金属铜 |
| D、NaHCO3俗称是小苏打,可用作食用碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
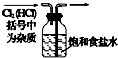 | 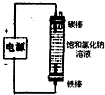 | 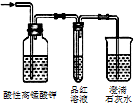 | 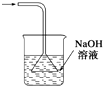 |
| 除去氯气中的杂质 | 制取84消毒液(NaClO) | 检验二氧化硫中是否混有二氧化碳 | 吸收氯化氢尾气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
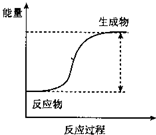 (1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是
(1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是查看答案和解析>>
科目:高中化学 来源: 题型:
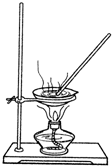 某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃.
某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕:c(KOH) |
| B、相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比 |
| C、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| D、液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Ca2+、ClO-、NO3- |
| B、K+、Na+、AlO2-、CO32- |
| C、K+、CO32-、C6H5OH、SO42- |
| D、Na+、K+、Cl-、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA |
| B、常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA |
| C、常温常压下,22.4L的氧气中含氧原子数为2NA |
| D、18g H2O含有的电子数8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com