
| A、2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA |
| B、常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA |
| C、常温常压下,22.4L的氧气中含氧原子数为2NA |
| D、18g H2O含有的电子数8NA |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴下面的氧气含量比液滴边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴下面的氧气含量比液滴边缘少.下列说法正确的是( )| A、(a)区腐蚀比(b)区腐蚀严重 |
| B、该过程发生了化学反应:4Fe+3O2→2Fe2O3 |
| C、该过程是析氢腐蚀,负极反应为:Fe-2e-→Fe2+ |
| D、该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
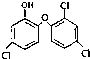
| A、1 mol三氯生最多能与6mol H2反应 |
| B、三氯生的分子式是C12H6Cl3O2 |
| C、三氯甲烷与甲烷均无同分异构体 |
| D、1 mol三氯生最多能与7 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2都是还原产物 |
| B、H2都是氧化产物 |
| C、NaH中的氢元素被还原 |
| D、氧化产物与还原产物质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32克O2所含的原子数目为2NA |
| B、0.5molSO2含有的原子数目为1.5NA |
| C、0.5molSO2含有的分子数目为1.5NA |
| D、0.5NA个氯气分子(标况下)的体积是11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于1.06 g |
| B、大于2.86 g |
| C、等于2.86 g |
| D、大于1.06 g小于2.86 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)2 |
| B、Cu(NO3)2 |
| C、Fe(NO3)3 |
| D、HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com