
【题目】燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e-![]() CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
【答案】D
【解析】
燃料电池中,通入燃料的电极失电子发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,所以为负极,通入氧化剂的电极得电子发生还原反应,电极反应式为:2O2+4H2O+8e-═8OH-,所以为正极;所以电池反应式为:2O2+CH4+2OH-═CO32-+3H2O,根据总反应式判断溶液的pH变化;由电子的流向,判断溶液中离子的移动方向。
A.负极上CH4失电子发生氧化反应,故A错误;
B.燃料电池中,通入燃料的一极为负极,负极上失电子发生氧化反应,甲烷失电子生成二氧化碳和水,二氧化碳能和碱反应生成碳酸盐和水,所以负极电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故B错误;
C.该电池反应式为2O2+CH4+2OH-═CO32-+3H2O,消耗了溶液中的氢氧根离子,且有溶剂水生成,导致溶液中氢氧根离子的浓度降低,故C错误;
D.放电时,电子从负极经外电路流向正极,溶液中的阳离子移向正极,阴离子移向负极,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
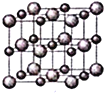
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸在生命化学中起重要作用,也是重要的化工原料,因此成为近年来的研究热点。下图是获得乳酸的两种方法,其中A是一种常见的烃,它的产量可以用来衡量一个国家的石油化工发展水平。
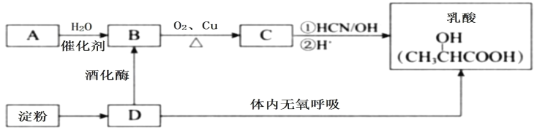
(1)上述有机物中有一种可作为水果的催熟剂,其结构简式是___________。淀粉完全水解得到D,D的名称是__________,检验是否还有淀粉的试剂是_________________________。
(2)A→B的反应类型是_______;B→C反应的化学方程式是__________________________________。
(3)B可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化为有机物E,B与E可在浓硫酸催化作用下反应生成酯(C4H8O2)。已知实验中60gE与足量B反应后生成66 g该酯,则该酯的产率(实际产量占理论产量的百分数)为______________。
(4)为检验淀粉水解产物,小明向淀粉溶液中加入稀硫酸并加热一段时间,冷却后的溶液中直接加入新制氢氧化铜悬浊液,加热,无砖红色沉淀出现,你认为小明实验失败的主要原因是_______
(5)乳酸与铁反应可制备一种补铁药物,方程式为(未配平):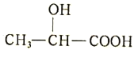 +Fe→
+Fe→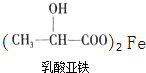 +X;则45g乳酸与铁反应生成 X 的体积为_______L(标准状况)。
+X;则45g乳酸与铁反应生成 X 的体积为_______L(标准状况)。
(6)两分子乳酸在一定条件下通过酯化反应可生成一分子六元环酯(C6H8O4)和两分子水,该环酯的结构简式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 通入 BaCl2 溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧 Y 形管中放置的药品组合符合要求的是( )
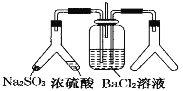
①Cu 和浓硝酸 ②氢氧化钠固体和浓氨水 ③大理石和稀盐酸 ④过氧化氢和二氧化锰
A. ①②④B. 全部C. ②③D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料岀现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他稀土原料。
(1)钕(Nd)为60号元素,在周期表中第_________周期;基态铁原子的外围电子轨道表示式为__________________。
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。
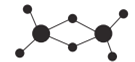
①已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于_________分子(填“极性”或“非极性”),分子中A1原采取__________________杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________(填选项字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(3)B元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为__________________(用元素符号表示)。
(4)因材料中含有大量的钕和铁,容易锈蚀是它的一大弱点。可电镀镍(Ni)、锌(Zn)等进行表面涂层处理。已知Ni可以形成[Ni(NH3)6]Cl2,该配合物中配体分子的空间构型为__________________。
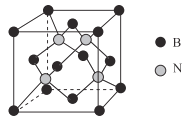
(5)已知立方BN晶体硬而脆,其原因是___________________________;其晶胞结构如图所示,N原子填充在B原子构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为__________________,设晶胞中最近的B、N原子之间的距离为anm,晶体的密度为bg·cm-3,则阿伏加德罗常数为_________mol-1(列式即可,用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单离子半径:b>e
B. 常温常压下,a与c形成的化合物可能呈固态
C. 单质沸点:c<d
D. d与e不能存在于同一离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
B. 常温常压下,ag某气体含分子数为b,则cg该气体的体积为![]()
C. 2mol/L的CaCl2溶液中Cl-的数目为4NA
D. 46g NO2和N2O4的混合气体中含有的氧原子个数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组设计实验探究氮的化合物的性质,装置如图所示,其中A(装置未画出)为气体发生装置。检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解。
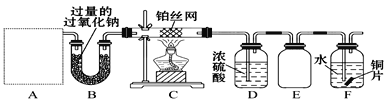
(1)若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
(2)装置B的作用是__________________________________。
(3)装置C中发生反应的化学方程式为_________________。
(4)该装置存在的主要缺陷是____________________。
(5)下图所示的E装置可防止F中溶液倒吸进入D中,请在图中画出装置E中的导气管_________________。

(6)若进入F装置的物质成分和质量一定,可向F中加入下列物质(填字母)中的___________使铜片溶解的质量增多。
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
(7)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是___________。
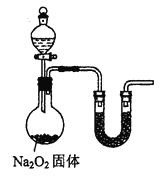
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产、生活中有重要作用。
Ⅰ.有资料显示过量的NH3和Cl2在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
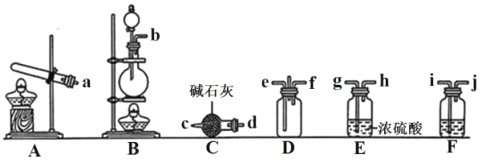
①利用装置A制取实验所需的NH3,写出反应的化学方程式__。
②已知该实验中用浓盐酸与MnO2反应制取所需Cl2,其离子反应方程式为__;装置F中的试剂是__。(填名称)
③为了使NH3和Cl2在D中充分混合,则由__(填e或f)通入NH3;请确定上述装置的合理连接顺序:A→__→D←__←__←__(用大写字母和箭头表示,箭头方向与气流方向一致)。
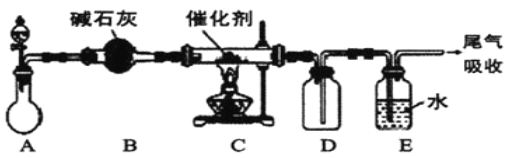
Ⅱ.(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是__。(填化学式)
②C装置中发生反应的化学方程式为__。
③反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是__,该离子的检验方法为__。
④下列哪些装置可以同时起到装置D和E的作用__(填代号)。
a.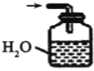 b.
b.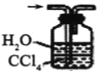 c.
c.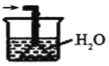 d.
d.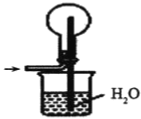
Ⅲ.饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原成N2。
(1)配平方程式:__Al+__NO3-+__OH-=__AlO2-+__N2↑+__H2O。
(2)上述反应中,当有0.3mol电子转移时,产生的氮气在标准状况下的体积为__mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com