
A、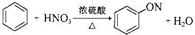 | |||
| B、H2C=CH2+Br2→CH3CHBr2 | |||
C、CH3COOH+CH3CH2OH
| |||
D、CH4+2O2
|
 ,故A错误;
,故A错误;| 浓硫酸 |
| △ |
| 点燃 |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| 反应物物质的量之间的关系 | 此阶段被氧化的离子的符号 | 被氧化离子的物质的量 | ||||
| 0<c≤a | ① | ② | ||||
a<c≤
| ③ | ④ | ||||
| ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用干燥的pH试纸测定某氯水的pH |
| B、做完银镜反应的试管可以用氨水来洗涤 |
| C、为了除去乙酸乙酯中混有的少量乙酸,加入足量氢氧化钠溶液,充分搅拌后分液 |
| D、如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用浓硝酸除去铝制品表面的铜镀层 | ||
B、用催化法处理汽车尾气中的CO和NO:CO+NO
| ||
| C、浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 | ||
| D、因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃,1.01×l05Pa下,1.12L O2含有的分子数是0.05NA |
| B、在25℃,1.01×106Pa下,0.1mol N2含有的原子数是0.2NA |
| C、在同温同压下,同体积任何气体所含原子数相同 |
| D、在同温同压下,两种气体的密度比等于质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
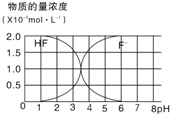 请按要求完成下列各小题:
请按要求完成下列各小题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com