
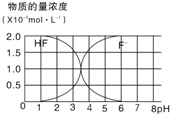
 请按要求完成下列各小题:
请按要求完成下列各小题:10-7×
| ||||
|
| b×10-7 |
| c-b |
| b×10-7 |
| c-b |


科目:高中化学 来源: 题型:
A、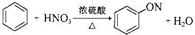 | |||
| B、H2C=CH2+Br2→CH3CHBr2 | |||
C、CH3COOH+CH3CH2OH
| |||
D、CH4+2O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠是电和热的良导体 |
| B、钠在空气中燃烧生成氧化钠,并发出黄色火焰 |
| C、钠与硫化合时可以发生爆炸 |
| D、钠离子半径比钠原子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量前先调节托盘天平的零点 |
| B、称量时左盘放被称量物,右盘放砝码 |
| C、潮湿的或具有腐蚀性药品必须放在玻璃器皿中称量,其他固体药品可直接放在天平托盘上称量 |
| D、称量完毕,应把砝码放回砝码盒中 |
| E、用托盘天平可称准到0.01g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棕红色的NO2加压后颜色先变深后变浅 |
| B、氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C、黄绿色的氯水光照后颜色变浅 |
| D、合成氨工业使用高压以提高氨的产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝在空气中能很快形成氧化膜 |
| B、氧化膜的熔点比铝高 |
| C、氧化膜与盐酸不反应 |
| D、外焰温度未达到氧化膜的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌是负极、铜是正极 |
| B、电子从铜片经导线流向锌片 |
| C、负极的反应式为2H++2e-═H2↑ |
| D、反应一段时间后,溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| B、不含金属元素的化合物也可能是离子化合物 |
| C、变价金属一定是过渡元素 |
| D、显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com