
 ,
, ;
; ;
; ;
; ;
; .
.


科目:高中化学 来源: 题型:
| A、在25℃,1.01×l05Pa下,1.12L O2含有的分子数是0.05NA |
| B、在25℃,1.01×106Pa下,0.1mol N2含有的原子数是0.2NA |
| C、在同温同压下,同体积任何气体所含原子数相同 |
| D、在同温同压下,两种气体的密度比等于质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、下列仪器中①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥滴定管;⑦燃 烧 匙,常用于物质分离的是①③⑤ |
| B、甲酸溶液滴到大理石台板上有气泡产生:2H++CaCO3═CO2↑+Ca2++H2O |
| C、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
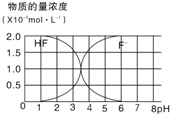 请按要求完成下列各小题:
请按要求完成下列各小题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡含离子键的化合物,一定含金属元素 |
| B、在化合物MgCl2中,两个氯离子之间也存在离子键 |
| C、离子化合物一定能导电 |
| D、原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是第ⅡA族元素 |
| B、一定是金属元素 |
| C、一定是化合物中呈+2价元素 |
| D、可能是金属元素,也可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“半成品碳”在硫酸溶液中加热可能发生的是消去反应 |
| B、“半成品碳”是碳元素的一种新单质 |
| C、蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成 |
| D、焦糖烯是一种新型的烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯气通入H2O2和NaOH的混合溶液中,发出红光,说明反应物的总能量低于生成物的总能量,放出热量 |
| B、1mol H2在氯气中完全燃烧,放出180kJ热量,则键能(E)的关系为E(H-H)=180kJ+2E(H-Cl)-E(Cl-Cl) |
| C、干燥的碘粉与铝粉混合无明显现象,滴上一滴水会冉冉升起紫色的碘蒸气,最后得到白色AlI3.说明碘和铝发生的反应是放热反应 |
| D、精确实验测得H2O在常温下也能微弱电离:H2O?H++OH-,该过程是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com