
【题目】(1)44.4g某二价金属的氯化物中含有0.8molCl-,该金属的相对原子质量为_______ 。
(2)如果mg氨气由a个原子构成,则2mg硫化氢中含有的分子数为__________(用含a的代数式表示)。
(3)0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则单质Ax的化学式是_____________。
(4)现有未知浓度的盐酸25mL,能跟20mL某浓度的氢氧化钠溶液完全反应。若先用0.1g碳酸钙与25mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4mL才能中和。氢氧化钠溶液的物质的量浓度为_______。
【答案】40 0.25a A4 0.125mol·L-1
【解析】
(1)44.4g某二价金属的氯化物中含有0.8molCl-,则该氯化物的物质的量是0.8mol÷2=0.4mol,所以该氯化物的相对分子质量是44.4g÷0.4mol=111g/mol,因此该金属的相对原子质量为111-35.5×2=40。
(2)如果mg氨气由a个原子构成,则![]() ,即NA=17a/4m,则2mg硫化氢中含有的分子数为
,即NA=17a/4m,则2mg硫化氢中含有的分子数为![]() =0.25a。
=0.25a。
(3)0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则根据三者的化学计量数之比是1:6:4,即方程式为Ax+6B2=4AB3,根据质量守恒定律可知单质Ax的化学式是A4。
(4)设4mLNaOH溶液能中和未知浓度的盐酸溶液的体积为X,由于未知浓度的盐酸25mL,能跟20mL某浓度的氢氧化钠溶液完全反应,则20mL:25mL=4mL:X,解得X=5mL,即与0.1gCaCO3反应盐酸溶液的体积为25mL-5mL=20mL。设20mL盐酸中含HCl的物质的量为Y,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100g 2mol
0.1g Y
解得Y=0.002mol
所以盐酸溶液中溶质的物质的量浓度为0.002mol÷0.02L=0.1mol/L
设20mL某浓度的NaOH溶液中含氢氧化钠的物质的量为Z,则
HCl+NaOH=NaCl+H2O
1mol 1mol
0.0025mol Z
解得Z=0.0025mol
因此NaOH中溶液中溶质的物质的量浓度为0.0025mol÷0.02L=0.125mol/L。


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气:KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)。
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目____________。
(2)将上述配平的化学方程式改写为离子方程式________________________。
(3)浓盐酸在反应中显示出来的性质是____________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5 mol Cl2,则被氧化的HCl_______mol,转移的电子的数目约为____。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。__MnO4-+ C2O42-+ = Mn2++ CO2↑+ ,完成上述离子方程式,此反应中,发生氧化反应的物质是______;若转移1 mol电子,生成标准状况下CO2_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,下列操作或发生事故时的处理方法正确的是
A. 可用燃着的酒精灯引燃另一只酒精灯。
B. 给试管里的液体加热时,试管应与桌面垂直。
C. 配置一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线。
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%-5%的小苏打溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列五种烃:

其中互为同分异构体的是_________________(填序号),②③④⑤四种物质按它们的沸点由低到高的顺序是________________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由少到多的顺序为________________ 。
(2) 的系统命名为___________________;
的系统命名为___________________;
(3)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、二甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是 ______
A.红外光谱 B. 1H核磁共振谱 C.质谱法 D.与钠反应
(4)已知乙烯分子是平面结构, 1,2-二氯乙烯可形成![]() 和
和![]() 两种不同空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是_____
两种不同空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是_____
A.1-丙烯 B.4-辛烯 C.1-丁烯 D.2-甲基-1-丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表除去括号内杂质所用的试剂和方法都正确的是( )
选项 | 物质 | 所用试剂 | 方法 |
A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
B | 乙醇(水) | 生石灰 | 分液 |
C | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:
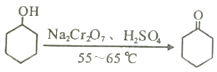
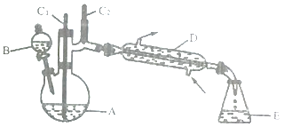
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__________________。
(2)酸性Na2Cr207溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液__________________________________;
②蒸馏不能分离环己酮和水的原因是_____________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏、除去乙醚后,收集151~156℃馏分
b. 水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c. 过滤
d. 往液体中加入NaCl固体至饱和,静置,分液
e. 加入无水MgSO4固体,除去有机物中少量的水
① 上述提纯步骤的正确顺序是______________________________;
② b中水层用乙醚萃取的目的是______________________________________;
③ 上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_____________,操作d中,加入NaCl固体的作用是______________________________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
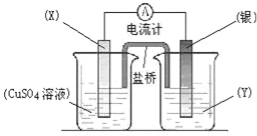
(1)电极X的材料是 (化学式);电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.4 g Na2CO3·10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留物的质量是
A. 5.28g B. 2.12g C. 4.22g D. 3.18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是( )
A. 金属钠着火,立即用水扑灭
B. 实验结束后,用嘴吹灭酒精灯
C. 皮肤不慎沾上NaOH溶液,立即用盐酸冲洗
D. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com