
【题目】(1)有下列五种烃:

其中互为同分异构体的是_________________(填序号),②③④⑤四种物质按它们的沸点由低到高的顺序是________________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由少到多的顺序为________________ 。
(2) 的系统命名为___________________;
的系统命名为___________________;
(3)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、二甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是 ______
A.红外光谱 B. 1H核磁共振谱 C.质谱法 D.与钠反应
(4)已知乙烯分子是平面结构, 1,2-二氯乙烯可形成![]() 和
和![]() 两种不同空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是_____
两种不同空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是_____
A.1-丙烯 B.4-辛烯 C.1-丁烯 D.2-甲基-1-丙烯
【答案】 ②④ ③<⑤<②<④ ⑥<①<③ 2,2,6-三甲基-4-乙基辛烷 D B
【解析】试题分析:(1)同分异构体是分子式相同、结构不同的有机物;随碳原子数的增多,烃的沸点升高,碳原子数相同,支链越少沸点越高;等质量的烃完全燃烧,氢元素质量分数越大耗氧量越大。(2)根据有机物系统命名原则命名;(3)红外光谱能测官能团种类、核磁共振谱能测“等效氢”、质谱法测相对分子质量、与钠反应可以检验羟基;(4)顺反异构是双键碳两侧碳原子所连原子或原子团不同;
解析:(1)①分子式是C4H8,②分子式是C5H12,③分子式是C3H8,④分子式是C5H12,⑤分子式是C4H10,⑥分子式是C8H10,②④分子式相同,结构不同,属于同分异构体;随碳原子数的增多,烃的沸点升高,碳原子数相同,支链越少沸点越高,所以②③④⑤四种物质按它们的沸点由低到高的顺序是③<⑤<②<④;等质量的烃完全燃烧,氢元素质量分数越大耗氧量越大,①③⑥氢元素的含量分别是![]() 、
、![]() 、
、![]() ,所以完全燃烧时消耗O2的物质的量由少到多的顺序为⑥<①<③。(2)根据系统命名原则,主链最长、从离支链最近的一端给主链碳原子编号,
,所以完全燃烧时消耗O2的物质的量由少到多的顺序为⑥<①<③。(2)根据系统命名原则,主链最长、从离支链最近的一端给主链碳原子编号, 的名称是2,2,6-三甲基-4-乙基辛烷;(3)红外光谱能测官能团,乙醇(CH3CH2OH)、二甲醚(CH3OCH3)官能团不同,红外光谱可以鉴别;核磁共振谱能测“等效氢”,乙醇(CH3CH2OH)有3种等效氢、二甲醚(CH3OCH3)有1种等效氢,核磁共振谱可以鉴别;质谱法测相对分子质量,乙醇(CH3CH2OH)、二甲醚(CH3OCH3)相对分子质量相同,质谱法不能鉴别,乙醇(CH3CH2OH)与钠反应放出氢气,二甲醚(CH3OCH3)与钠不反应,与钠反应可以鉴别;故选C。(4)1-丙烯只有
的名称是2,2,6-三甲基-4-乙基辛烷;(3)红外光谱能测官能团,乙醇(CH3CH2OH)、二甲醚(CH3OCH3)官能团不同,红外光谱可以鉴别;核磁共振谱能测“等效氢”,乙醇(CH3CH2OH)有3种等效氢、二甲醚(CH3OCH3)有1种等效氢,核磁共振谱可以鉴别;质谱法测相对分子质量,乙醇(CH3CH2OH)、二甲醚(CH3OCH3)相对分子质量相同,质谱法不能鉴别,乙醇(CH3CH2OH)与钠反应放出氢气,二甲醚(CH3OCH3)与钠不反应,与钠反应可以鉴别;故选C。(4)1-丙烯只有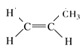 一种结构;4-辛烯有
一种结构;4-辛烯有 、
、 2种结构;1-丁烯只有
2种结构;1-丁烯只有 一种结构;2-甲基-1-丙烯只有
一种结构;2-甲基-1-丙烯只有![]() 一种结构,选B。
一种结构,选B。


科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
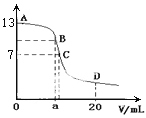
A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1 的较浓氨水沿玻璃棒加人到u mL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀氨水。若c1 =2c2,则:
A. w1>2w2,u>50 B. w1<2w2,u<50 C. w1=2w2,u<50 D. w1<2w2,u>50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,商品名富血铁,含铁量高(33%),较难被氧化为三价铁,在胃内铁不直接游离,对胃黏膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂。实验采用反丁烯二酸(又称富马酸)为原料,在适当的pH条件下与Fe2+形成配合物。如图是合成富马酸铁的一种工艺路线:

回答下列问题:
(1)A的结构为_________(用结构简式或键线式表示),由A生成B的反应类型为__________
(2)C在NaOH乙醇溶液中反应的方程式为________
(3)富马酸的结构简式为__________
(4)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出_____ LCO2(标况下);富马酸的同分异构体中(包含顺反异构),同为二元羧酸的还有____(写出结构简式)。
(5)用石油裂解中得到的1,3-丁二烯合成丁烯二酸时,![]() 是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到
是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到![]() 的变化过程._____________
的变化过程._____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是( )
A.n=m+16
B.n=m+6
C.n=m+30
D.n=m+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中C02的含量及有效地开发利用CO2,已引起了全世界的普遍重视。
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
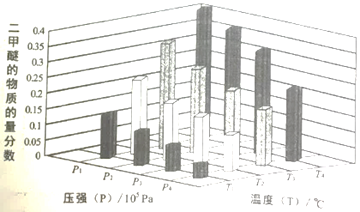
某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时、改变压强和温度,平衡体系中CH3OCH3(g)的物质分数变化情况如图所示,则p1______p2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1______K3,T1、P1时H2的平衡转化率为____________。
②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______(填序号)。
A. 反应物的浓度增大 B. 混合气体的密度减小
C. 正反应速率小于逆反应速率 D. 氢气的转化率减小
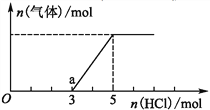
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:通入1mol HCl时,溶液中所含溶质的化学式_____________,a点溶液中各离子浓度由大到小的关系式为___________________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其![]() 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为![]() mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________mol·L-1.
mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________mol·L-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)44.4g某二价金属的氯化物中含有0.8molCl-,该金属的相对原子质量为_______ 。
(2)如果mg氨气由a个原子构成,则2mg硫化氢中含有的分子数为__________(用含a的代数式表示)。
(3)0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则单质Ax的化学式是_____________。
(4)现有未知浓度的盐酸25mL,能跟20mL某浓度的氢氧化钠溶液完全反应。若先用0.1g碳酸钙与25mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4mL才能中和。氢氧化钠溶液的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向澄清饱和石灰水中通入二氧化碳,测得溶液导电性(I表示导电能力)的变化,以下与加入物质量的关系正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。Na2O2样品与过量水反应,待完全反应不再产生氧气后,得溶液X。查阅资料表明,Na2O2与水反应还可生成H2O2。
(1)写出Na2O2与水生成O2的化学反应方程式______________,每生成1mol O2,转移电子的物质的量为______________。
(2)Na2O2与水反应生成H2O2的反应是否属于氧化还原反应_______(填是、否)。
(3)若已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:____MnO4-+____H2O2+____H+—____Mn2++____O2↑+____ 。____________
(4)取40 gNa2O2固体粉末与一定量二氧化碳反应后,固体质量变为47g,则该反应中消耗Na2O2的质量是________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com