
����Ŀ��ij��ѧ��ȤС��Ϊ����ȡ��̽���������ʣ�������װ��(���ּг�װ������ȥ)����ʵ�顣[��ȡ�����ķ�Ӧԭ����2NH4Cl+Ca(OH)2=CaCl2+2NH3��+2H2O]

��ʵ��̽����
(1)��������ԭ����ʵ������ȡ����Ӧѡ����ͼ�� ����װ�ý���ʵ�顣
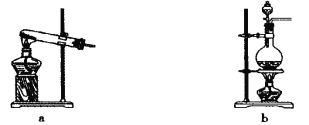
(2)Bװ���еĸ������ѡ�� (���ʯ�ҡ���Ũ���ᡱ)��
(3)��5.35 g NH4Cl����������Ca(OH)2��Ӧ�������Ƶñ�״���°��������Ϊ L��(NH4Cl��Ħ������Ϊ53.5 g��mol��1)
(4)����ͨ��C��Dװ��ʱ����ֽ��ɫ�ᷢ���仯���� (�C����D��)��
(5)��ʵ�����һ��ʱ���ѹEװ���еĽ�ͷ�ιܣ�����1��2��Ũ���ᣬ�ɹ۲쵽�������� ��
(6)Fװ���е���©�������� ��
����չӦ�á�
(7)ijͬѧ�ð����͵μӷ�̪��ˮ����Ȫʵ�飬������ƿ�ڲ�����ɫ��Ȫ������˵���������� ����(�����)��
a����ԭ�� b����������ˮ c����ˮ��Ӧ���ɼ�������
(8)��������;�ܹ㡣����ð����������������� 8NH3 + 6NO2 =7N2 + 12H2O
�÷�Ӧ�а������� (������ԡ���ԭ�ԡ�)��
�����оٳ���������һ����; ��
���𰸡�(12��)
��1��a(1��)
��2����ʯ��(1��)
��3��2.24(2��)
��4��D(1��)
��5����������(1��)
��6����ֹ����(1��)
��7��bc(˵������ֻѡb��ֻѡc��1�֣�����ֻҪ����a������)����(2��)
��8����ԭ��(2��)��������ڵ���(��)��ԭ�Ϣ������ԭ�Ϣܻ���ԭ��
��������ѡ��һ��������������Ҳ���֣�(1��)
��������
���������
��1����������ԭ����Ϊ��������ͣ���ѡ��aװ�á�
��2������Ϊ�������壬�����ü�ʯ�Ҹ��
��3��5.35 g NH4Cl�������ʵ���Ϊ0.1mol�����ݷ�Ӧ����ʽ�������Եõ�0.1mol��������״���°��������Ϊ2.24L��
��4��������ˮ��Ӧ���ɵ�һˮ�ϰ�����ʼ��ԣ�ʹ��ɫʯ����ֽ������������ͨ��C��Dװ��ʱ����ֽ��ɫ�ᷢ���仯����ʪ��ĺ�ɫʯ����ֽ����D��
��5��Ũ�����백����Ӧ�����Ȼ�粒��壬�ɹ۲쵽��������������
��6��Fװ���е���©���������Ƿ�ֹ������
��7�������͵μӷ�̪��ˮ������ɫ��Ȫ��˵��������������ˮ������ˮ��Ӧ���ɼ���������
��8��NH3ת��ΪN2����̬���ߣ����ְ�����ԭ�ԡ��������ж�����;������������ڵ���(��)��ԭ�Ϣ������ԭ�Ϣܻ���ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Է���мΪԭ���Ʊ������������壨FeC2O4��xH2O�����������£�

��֪����pH>4ʱ��Fe2+�ױ�����������
��������ʵ��ܽ��������ͼ��

��1���ٷ���м�ڽ��С��ܽ⡱ǰ����Ҫ��5%��Na2CO3 ��Һ�м��������ӣ���ϴ�Ӹɾ���Na2CO3��Һ��������____________��
����ϡ�������ҺpH��1��2��Ŀ�ģ�һ������Fe2+ ��NH4+��ˮ�⣻���� ________��
�۲���I��Ϊ�˵õ�(NH4)2SO4��FeSO4��6H2O�������IӦ��������Ũ�����ᾧ�����ˡ���ô����ʱ���˵��¶�Ϊ__________��
�ܼ���FeC2O4��xH2O�����Ƿ�ϴ�Ӹɾ��ķ�����____________��
��2��ͨ������֪Ũ�ȵ����Ը��������Һ�ⶨ������������Ĵ��ȡ���֪����������MnO4��ת��ΪMn2+��д��MnO4����Fe2+��Ӧ�����ӷ���ʽ��____________��
��3��ij�о���ѧϰС��������������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3�����������Ʊ��ϴ�����FeSO4��Һ���ٺϳ�FeC2O4��xH2O���벹�������������������Ʊ�����FeSO4��Һ��ʵ�鲽�裨��ѡ�õ��Լ������ۡ�ϡ�����NaOH��Һ������һ���������������м���������ϡ�����ַ�Ӧ�����ˣ�____________�����ˣ��õ��ϴ�����FeSO4��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
A����ϡ��ˮ��μ���ϡ�����У�����ҺpH��7ʱ��c(SO![]() )>c(NH
)>c(NH![]() )
)
B�����ִ�����Һ�����ʵ���Ũ�ȷֱ�Ϊc1��c2��pH�ֱ�Ϊa��a��1����c1��10c2
C��pH��11��NaOH��Һ��pH��3�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ
D����0.1 mol/L�İ�ˮ�м�����������粒��壬����Һ��c(OH��)/c(NH3��H2O)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һͬѧ������Ͳ��ȡ������Һ�壬���ȸ��Ӱ�Һ�����ʹ�������Ϊ50mL������Һ����������Ӱ�Һ�����ʹ�������Ϊ10mL��ʵ�ʵ���Һ������Ϊ�� ��
A. 40mL B. ����40mL C. С��40mL D. ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص����ӷ���ʽ��д��ȷ����
A. ��ͭƬ�еμ�Ũ���Ტ���ȣ��д̼�����ζ���������Cu+4H++SO42-![]() Cu2++SO2��+2H2O
Cu2++SO2��+2H2O
B. ���ð�˾ƥ�ֹ�������ˮ���ᣨ![]() ���ж���Ӧ���ɾ���ע��NaHCO3��Һ��
���ж���Ӧ���ɾ���ע��NaHCO3��Һ��![]() +2HCO3-��
+2HCO3-��![]() +2CO2��+2H2O
+2CO2��+2H2O
C. 20mL1.0mol/L��������Һ��10mL3.5mol/L Ba��OH��2��Һ��ϳ�ַ�Ӧ��3Ba2++6OH-+2Al3++3SO42-=3BaSO4��+2Al��OH��2��
D. ��Ca��HCO3��2��Һ�м������NaOH��Һ���а�ɫ�������ɣ�Ca2++2HCO3-+2OH-�TCaCO3��+2H2O+CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������β���ķ���֮һ����������������װһ������ת�������������Ļ�ѧ��ӦΪ��2CO��2NO = N2��2CO2 �����е���������
A�� NO B��CO C��N2 D��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016�걱����������Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԡ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
2 mL | 0.2 mol��L1 Na2SO3��Һ | ����Ag2SO4��Һ | ��.������ɫ���� |
0.2 mol��L1 CuSO4��Һ | ��.��Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 mol��L1 Al2��SO4��3��Һ | ��.��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬�������еİ�ɫ������Ag2SO3�������ӷ���ʽ������������ ��
��2�������飬���������ػ�ɫ�����в���SO42������Cu+��Cu2+��SO32����֪��Cu+![]() Cu +Cu2+��Cu2+
Cu +Cu2+��Cu2+![]() CuI������ɫ��+I2��
CuI������ɫ��+I2��
����ϡ����֤ʵ�����к���Cu+��ʵ�������� ��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32��

a.��ɫ����A��BaSO4���Լ�1�� ��
b.֤ʵ�����к���Cu2+��SO32�������� _��
��3����֪��Al2��SO4��3��ˮ��Һ�в����ڡ������飬�������İ�ɫ��������SO42���ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������ ��
�����ڳ�������������Ĵ�����ʽ������ּ��裺i.��Al��OH��3��������ii.���������ļ�ʽ���С��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a.���Ա�ʵ�鷽������������

������� ������ͼ��ʽ���֣���
��4������ʵ�飬�������ε������� ������Һ�䷴Ӧ�Ķ������� �йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���X��Y ��0.16 mol����10 L �����ܱ������У�������Ӧ��2X(g)+ Y(s)![]() 2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�����˵����ȷ����( )
2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�����˵����ȷ����( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.10 | 0.09 | 0.09 |
A����Ӧǰ2min��ƽ������v(Z)=2.0��10-3 mol/(L��min)
B�������������䣬����һ������Y����Ӧ����һ���ӿ�
C����Ӧ����4sʱ��X��ת����75%
D����Ӧ�ﵽƽ��ʱ��X�����ʵ���Ũ��Ϊ0.02mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �ʱ���ر䶼����0�ķ�Ӧ�϶����Է���
B. �ʱ�С��0���ر����0�ķ�Ӧ�϶����Է���
C. ��Ϊ�ʱ���ر䶼�뷴Ӧ���Է����йأ�����ʱ���ر�����Ե�����Ϊ��Ӧ�Է��Ե��о�
D. ����������������������£�ʹ�ô������Ըı仯ѧ��Ӧ���еķ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com