
向绝热恒容密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g)=SO3(g)+NO(g),其正反应速率(v)随时间(t)变化的关系如下图所示。下列结论中错误的是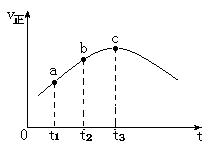
| A.反应在c点达到平衡状态 |
| B.反应物的浓度:a点大于b点 |
| C.反应物的总能量高于生成物的总能量 |
| D.逆反应速率:c点大于b点 |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:单选题
在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=?92. 4kJ·mol-1)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
| NH3的浓度( mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是 1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)TaI4(g) + S2(g),下列说法错误的是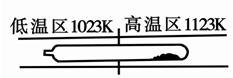
| A.在不同温度区域,TaI4 的量不同 |
| B.在提纯过程中,S2 的量不断增多 |
| C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大 |
| D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(B2)=1.2 mol·L-1·s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中,不能用平衡移动原理解释的是( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若要提高CO的转化率,则应该加入适当的过量FeO |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.026" 3 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com