
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
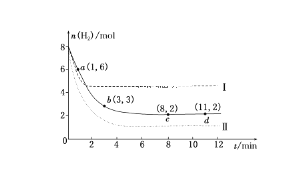
(1)a点正反应速率________(填“大于”“等于”或“小于”)逆反应速率。
(2)下列时间段平均反应速率最大的是________。
A.0~1 min B.1~3 min
C.3~8 min D.8~11 min
(3)平衡时CO2的转化率为________,该条件下的平衡常数K=________。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是________,曲线Ⅱ对应的实验条件改变是________。
【答案】(1)> (2)A (3)33.3﹪ K=0.5 (4)升高温度 增大压强。
【解析】
试题分析:(1)反应是从正反应方向开始的。由于在a点时反应还没有达到化学平衡,所以反应速率V(正)>V(逆) (2)反应是在体积固定的密闭容器中进行的,在反应的过程中物质的浓度越大,反应速率越快。由于在开始时反应物的浓度最大,所以在开始不久反应的速率最快。选项为A。(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)开始时C(CO2)=3mol/L,C(H2)="4mol/L." C(CH3OH)="0mol/L," C(H2O)= 0mol/L.当达到化学平衡时C(H2)=1mo/LC(CO2)=2mol/L,C(CH3OH)=1mol/L,C(H2O)=1mol/L.所以CO2的转化率为:(1mol/L÷3mol/L)×100﹪=33.3﹪.此时的化学平衡常数K="{" C(CH3OH)·C(H2O)} ÷{ C(CO2) ·C3(H2) } = (1×1)÷(2×13)= 0.5.(4) 仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对于曲线I来说,反应速率加快,达到平衡时n(H2)增多。说明平衡向逆反应方向移动。由于该反应的正反应是个气体体积减小的放热反应,所以要使速率加快,平衡逆向移动,对应的实验条件改变是升高温度 ,对于曲线II来说,反应速率加快,平衡时H2的含量降低。说明改变的外界条件是是速率加快而且平衡正向移动。则对应的实验条件改变是增大压强。
CH3OH(g)+H2O(g)开始时C(CO2)=3mol/L,C(H2)="4mol/L." C(CH3OH)="0mol/L," C(H2O)= 0mol/L.当达到化学平衡时C(H2)=1mo/LC(CO2)=2mol/L,C(CH3OH)=1mol/L,C(H2O)=1mol/L.所以CO2的转化率为:(1mol/L÷3mol/L)×100﹪=33.3﹪.此时的化学平衡常数K="{" C(CH3OH)·C(H2O)} ÷{ C(CO2) ·C3(H2) } = (1×1)÷(2×13)= 0.5.(4) 仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对于曲线I来说,反应速率加快,达到平衡时n(H2)增多。说明平衡向逆反应方向移动。由于该反应的正反应是个气体体积减小的放热反应,所以要使速率加快,平衡逆向移动,对应的实验条件改变是升高温度 ,对于曲线II来说,反应速率加快,平衡时H2的含量降低。说明改变的外界条件是是速率加快而且平衡正向移动。则对应的实验条件改变是增大压强。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
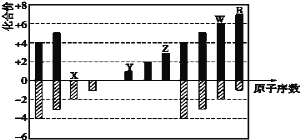
A.氢化物的沸点:H2W<H2X
B.WX3和水反应形成的化合物是离子化合物
C.X,Y,R形成的某种化合物可以用于漂白、消毒
D.Y,Z和W三者最高价氧化物对应的水化物能两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿酸是合成青蒿素的原料,可以由香草醛合成:

下列有关叙述正确的是
A. 香草醛的分子式是C8H10O3
B. 香草醛能与NaHCO3溶液反应
C. 两种物质均可与溴的四氯化碳溶液发生加成反应
D. 可用FeCl3溶液检验青蒿酸中是否含香草醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
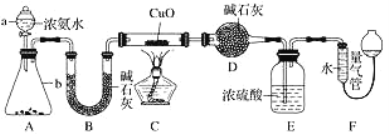
(1)仪器a的名称为_____;仪器b中可选择的试剂为________(填名称)。
(2)实验室中,利用装置A,还可制取的无色气体是______ (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式____________。
(4)E装置中浓硫酸的作用________。
(5)读取气体体积前,应对装置F进行的操作:__________。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.金属矿物资源以及海水资源的利用有着非常重要的意义。
Ⅰ(1)金属铁常用的冶炼方法是____________(填序号);
A.热分解法 B.热还原法 C.电解法 D.湿法冶金
(2)利用冶炼得到的铁屑和海带中提取的碘可以用于生产KI,其工艺流程如图所示:
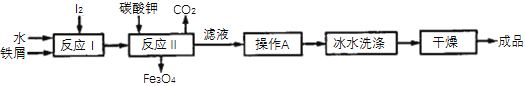
①操作A包括________________、_____________、过滤。
②用冰水洗涤的目的是:a除去附着在KI表面的可溶性杂质:b._________________。
③反应Ⅰ生成了铁与碘的化合物X,若X中铁元素与碘元素的质量比为21∶127,则X的化学式为__________________;反应Ⅱ中1molX完全反应生成89.6L(标准状况)CO2,写出反应Ⅱ的化学方程式:______________________________________________。
Ⅱ.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(3)气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓HSO4 b.稀HNO3 c.NaOH溶液 d.氨水
(4)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_____(填离子符号),检验溶液中还存在Fe2+的方案是:____________________________。
(5)在一定量的精铜中加入足量的稀HNO3溶液,该反应的离子方程式为________________。
(6)由泡铜冶炼粗铜的化学反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是

A. M的分子式为C18H20O2
B. M可与NaOH溶液或NaHCO3溶液均能反应
C. 1 mol M最多能与7 mol H2发生加成反应
D. 1 mol M与饱和溴水混合,最多消耗5 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:

(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应是在高温、高压和有催化剂存在的条件下,用氢气和氮气直接化合制取:3H2+N2![]() 2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A.为了提高H2的转化率。应适当提高N2的浓度
B.达到平衡时,c(NH3)一定是c(H2)的三分之二
C.使用催化剂是为了加快反应速率,提高生产效率
D.达到平衡时,氨气分解速率是氮气消耗速率的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com