
| A、一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、将0.2 mol/L的盐酸与0.1 mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al+)<c(Na+)<c(Cl-) |
| C、在0.1mol/LNa2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
| D、在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
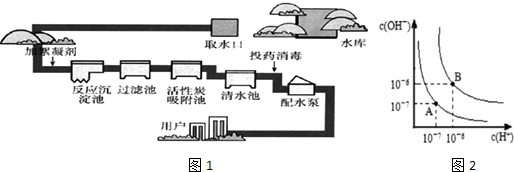
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.448L |
| B、0.896L |
| C、4.48L |
| D、8.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 |
| B、为了增加食物的营养成分,可以大量使用食品添加剂 |
| C、聚乙烯塑料的老化是由于发生了加成反应 |
| D、粮食酒主要经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在水层中反应并四处游动 |
| B、钠停留在煤油层中不发生反应 |
| C、钠在煤油的液面上反应并四处游动 |
| D、钠在煤油与水的界面处反应并可能作上下跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③④ | B、只有③⑤ |
| C、只有③④⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+H2O?HCl+HClO |
| B、NaOH+HCl=NaCl+H2O |
| C、2Na+2H2O=2NaOH+H2↑ |
| D、CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com