
����Ŀ��ij��Ȥ�С��ͨ��ʵ���о�Na2O2��ˮ�ķ�Ӧ��
���� | ���� |
��ʢ��4g Na2O2���ձ��м���50mL����ˮ�õ���Һa | ���ҷ�Ӧ��������ʹ������ľ����ȼ������ |
ȡ5mL��Һa���Թ��У��������η�̪ | i.��Һ��� ii.10���Ӻ���Һ��ɫ���Ա�dz���Ժ���Һ��Ϊ��ɫ |
(1)Na2O2��ˮ��Ӧ�Ļ�ѧ����ʽ��_______________________________��
(2)ii����Һ��ɫ��������Һa�д��ڽ϶��H2O2���̪�����˷�Ӧ��
I.��ͬѧͨ��ʵ��֤ʵ��H2O2�Ĵ��ڣ�ȡ������Һa�������Լ�___________(�ѧʽ)�������������
II.��ͬѧ�������ϻ�Ϥ����KMnO4���ԲⶨH2O2�ĺ�����ȡ15.mL��Һa����ϡH2SO4�ữ����μ���0.003 mol/L KMnO4��Һ���������壬��Һ��ɫ���ʿ�ʼ�������죬���յ�ʱ������20.00mLKMnO4��Һ��
������ƽ��_MnO4-+_H2O2+_____===_Mn2++_O2��+_H2O
����Һa�� c(H2O2)=_____mol��L-1��
����Һ��ɫ���ʿ�ʼ���������ԭ�������__________________________��
(3)Ϊ̽�����ii������ԭ��ͬѧ�Ǽ�������������ʵ�飺
iii.��H2O2��Һ�е������η�̪��������5��0.1 mol��L-1NaOH��Һ����Һ�����Ѹ�ٱ���ɫ�Ҳ������壬10���Ӻ���Һ����ɫ��
IV.��0.l mol��L-1NaOH��Һ�е������η�̪������Һ��죬10���Ӻ���Һ��ɫ�����Ա仯�������Һ��ͨ��O2����Һ��ɫ�����Ա仯��
�ٴ�ʵ��III��IV�У��ɵó��Ľ�����_________________________��
���𰸡� 2Na2O2+ 2H2O = 4NaOH + O2�� MnO2 2 5 6 H+ 2 5 8 0.01 ���ɵ� Mn2+������ ���������£��������������̪��Ӧ������������
��������(1)����ʵ�����������ʹ������ľ����ȼ������˵����������������Һ���˵���м����ɣ��ݴ�д��ѧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
(2)��.��ʹH2O2��������ͨ����MnO2��������
��.��KMnO4��H2O2��Ӧ�������������˵������������Һ��ɫ˵��KMnO4����ԭ���ٸ��ݵ��ӵ�ʧ�غ�͵���غ��д�����ӷ���ʽΪ��2MnO4-+5H2O2+6H+=2Mn2++5O2��+8H2O��
�ڸ���KMnO4��H2O2��Ӧ�����ӷ���ʽ��֪��ϵʽΪ��
2MnO4-��5H2O2
2mol 5mol0.003molL-1��0.02L n(H2O2)
��n(H2O2)=1.5��10-4mol
��c(H2O2)=![]() =0.01mol/L��
=0.01mol/L��
��һ��������ڿ�ʼʱ��Ӧ��Ũ�Ƚϴ�Ӧ����Ӧ���Ͽ죬����������Һ��ɫ���ʿ�ʼ�������죬������Dz����µ����ʣ��Ҵ����ʶԷ�Ӧ�д����ã��Ӷ��ӿ��˷�Ӧ���ʣ��������ӷ�Ӧ2MnO4-+5H2O2+6H+=2Mn2++5O2��+8H2O����֪��������IJ���ΪMn2+��
(3)�ٷ����Աȷ����Ա�ʵ���͢�����֪�ڢ�����H2O2��Һ������������������������ͬ������������˲��죬��˵��������Һ�����Ѹ�ٱ���ɫ����H2O2�������������ʽ���Ϊ�����������£�H2O2�����̪��Ӧ��O2���ܡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�����Ϊ95 g���Ȼ�þ�ܽ���0.2 Lˮ����ˮ���ܶȽ���Ϊ1 g/mL��ǡ�õõ��Ȼ�þ�ı�����Һ��������Һ���ܶ�Ϊ�� g/mL�����ʵ���Ũ��Ϊc mol/L���ܽ��Ϊs��NA��ʾ�����ӵ�������ֵ����������������ȷ������������
A. ������Һ�к���NA���Ȼ�þ����
B. ������Һ�����ʵ���Ũ��Ϊ5 mol/L
C. ������Һ���ܽ�ȿɱ�ʾΪ9500 c/��1000��-95c��
D. ������Һ�����������ɱ�ʾΪ95 ��/��1000c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ѧ2017��ڶ���ģ�⡿����Ա����������CO2�����з�Ӧ��������ʵ�ֿռ�վ��O2��ѭ�����á�
sabatior��Ӧ��CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
ˮ��ⷴӦ��2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
��1����ԭ������nCO2��nH2=1:4�����ܱ������з���Sabatier��Ӧ�����H2O(g)�����ʵ����������¶ȵĹ�ϵ��ͼ��ʾ(���߱�ʾƽ������)��
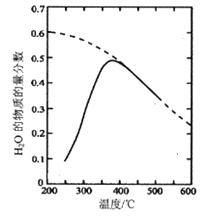
�ټ�֪H2(g)��CH4(g)��ȼ���ȷֱ�ΪA kJ/mol��BkJ/mol�� H2O(l)=H2O(g) ��H =C kJ��mol������Sabatier��Ӧ�ġ�H=___kJ/mol��
���¶ȹ�����;������ڸ÷�Ӧ�Ľ��У�ԭ����________��
��200��ﵽƽ��ʱ��ϵ����ѹǿΪp���÷�Ӧƽ�ⳣ��Kp�ļ���ʽΪ________��(���ػ�����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)
��2��Sabatier��Ӧ�ڿռ�վ����ʱ�����д�ʩ�����CO2ת��Ч�ʵ���______(����)��
A.�ʵ���ѹ B.��������ıȱ����
C.��Ӧ��ǰ�μ��ȣ������ȴ D.���ԭ������CO2��ռ����
E.�������Ʒ�Ӧ�������������
��3�� һ���µ�ѭ�����÷�������Bosch��ӦCO2(g)+2H2(g)![]() C(s)+2H2O(g)����Sabatier��Ӧ��
C(s)+2H2O(g)����Sabatier��Ӧ��
��250�棬�����Ϊ2L�Ҵ���ѹ�Ƶĺ����ܱ�������ͨ��0.08molH2��0.04molCO2����Bosch ��ӦCO2(g)+2H2(g)![]() C(s)+2H2O(g) �� H
C(s)+2H2O(g) �� H
������Ӧ��ʼ��ƽ��ʱ�¶���ͬ(��Ϊ250��)����÷�Ӧ������ѹǿ(P)��ʱ��(t)�ı仯��ͼI ����a��ʾ�����H___ 0(�>����<����ȷ����) ��������������ͬ�����ı�ijһ����ʱ�������ѹǿ(P)��ʱ��(t)�ı仯��ͼI ����b��ʾ����ı��������______________��
��ͼII�Ǽס�����ͬѧ���������Ӧƽ�ⳣ���Ķ���ֵ(lgK)���¶ȵı仯��ϵ��������ȷ��������____________(��ס����ҡ�)��mֵΪ____________��

��Bosch��Ӧ�����ڸ����²���������ԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2017����������ѧ�ڽ�ѧ�ʼ졿�ס��ҡ�����X����ѧ��ѧ�г�����4�����ʣ���ת����ϵ��ͼ�����м�X��������

A����ΪC2H5OH��XΪO2 B����ΪH2S��XΪO2
C����ΪHNO3 ��XΪFe D����ΪAlCl 3 ��Һ��XΪNaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У�������ǣ�������
A. �ƺ���ˮ��Ӧ��2Na+2H2O�T2Na++2OH��+H2��
B. AlCl3��Һ�м��������İ�ˮ��Al3++4OH���TAlO2��+2H2O
C. ������ͨ��ˮ�У�Cl2+H2O![]() Cl��+HClO+H+
Cl��+HClO+H+
D. ��Fe��NO3��2��Һ�м���ϡ���3Fe2++4H++NO3���T3Fe3++NO��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ�����ȷ����( )
������ | ���������� | ���������� | ǿ����� | |
�� | Ư�� | SiO2 | CO2 | AlCl3��Һ |
�� | CuSO45H2O | Na2O2 | N2O5 | NH4NO3 |
�� | �������� | CaO | Mn2O7 | HClO |
�� | ������ | Na2O | SO2 | HCl |
A. �� B. �� C. �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ĺ�ҵ�Ʒ��У��������
A�����ƣ��Ժ�ˮΪԭ���Ƶ�NaCl���ٵ������NaCl����
B���������Խ�̿������ʯΪԭ�ϣ���CO��ԭ����ʯ����
C���ƹ裺�ý�̿��ԭ��������ù�
D����þ���Ժ�ˮΪԭ�ϣ���һϵ�й����Ƶ��Ȼ�þ����H2��ԭMgCl2��þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2+��һ�ַdz��õĻ�ԭ�����ܹ���ܶ�������������Ӧ��
(1)�ڼ��������£�FeSO4���������ữ��KNO3��Ӧ�����е�Fe2+ȫ��ת����Fe3+��KNO3Ҳ��ȫ��Ӧ���ų�NO���塣
����д���û�ѧ��Ӧ����ʽ�����õ����ű�ʾ������ת�Ƶķ������Ŀ_________________��
��������Ӧ������ԭ��Ӧ��������______________ ��
����11.4gFeSO4���뷴Ӧ�������NO��������(�����)___________L��
(2)������FeS�ܹ��������ữ��KMnO4��Һ��Ӧ����Ӧ����ʽ���£�
10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+l0 +24H2O
�ٺ����ϵ����ʵĻ�ѧʽ��___________��
�ڸ÷�Ӧ������������______________��
����������Ӧǰ����������������2.8g������Ԫ����KMnO4֮�䷢��ת�Ƶĵ�����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��pHֵ������˵����ȷ����
A. pH=0����Һ������ B. ijǿ����Һ��Ũ��Ϊ0.01 mol/L������Һ��pHֵһ��Ϊ12
C. ��ҺpHֵԽ��������Ũ��Խ�� D. ������Һ�У�������Ũ��һ������������Ũ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com