


科目:高中化学 来源: 题型:
| A、0.46mol |
| B、0.4mol |
| C、0.28mol |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
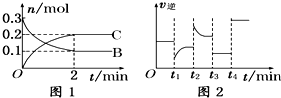 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )| A、t1时改变的条件可能是升高温度 |
| B、t2时改变的条件可能是增大B的浓度 |
| C、t3时改变的条件可能是加压,此时c(B)不变 |
| D、t4时可能是使用了催化剂,此时c(B)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4 |
| B、KClO3 |
| C、CaCl2 |
| D、Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、撒了融雪盐的积雪融化后对周边的植被及河流没有影响 |
| B、融雪盐能与冰反应生成水 |
| C、应大力推广使用融雪盐去除道路积雪 |
| D、过量使用融雪盐会加速钢铁桥梁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为14,中子数为8 |
| Y | Y与X同周期,且它的一种氧化物只能用排水法收集 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的原子核外电子总数是其电子层数的4倍 |
| A、原子半径:W>X>Y,离子半径:W>Z |
| B、氧化物对应的水化物的酸性:Z>Y>X |
| C、Y的最高正价含氧酸,可由它的氢化物为原料来制取 |
| D、W的单质与X的一种氧化物不能发生置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com