
【题目】燃煤尾气气和汽车尾是造成空气污染的主要原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
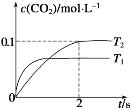
据此判断:
①在T2温度下,0~2 s内的反应速率v(N2)=_______mol /(L·s)。
②该反应的ΔH__________0(选填“>”或“<”)。
(2)煤燃烧产生的烟气中有含氮的氧化物NOx,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH<0
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH<0
①若在恒压下,将CH4(g)和NO2(g)置于密闭容器中,发生上述反应。提高NO2转化率的措施有____。
A.加入催化剂 B.降低温度 C.减小投料比[![]() ] D.增大压强
] D.增大压强
②在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等物质的量的NO和NO2。在不同温度下,同时分别发生上述的两个反应,并在t秒时测定其中NOx转化率,绘得图像如图所示:

从图中可以得出的结论是:
结论一:在250~450 ℃时,NOx转化率随温度升高而增大,450~600 ℃时NOx转化率随温度升高而减小。推测原因是_____________。
结论二:______________。
【答案】0.025 < BC 在250~450℃时,反应未达到平衡,温度升高反应正向进行,NOx转化率随温度升高而增大;450~600℃(温度较高)时,反应已达平衡,所以,温度升高平衡向逆反应方向移动,NOx转化率随温度升高而减小 相同温度下NO的转化率比NO2的低
【解析】
对于同一可逆反应,各物质的变化量之比等于化学计量数之比;升高温度,反应速率加快,达平衡的时间缩短,可从达平衡的时间判断温度的高低,并由此判断平衡移动的方向,最终可推出ΔH与0的关系。分析CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH<0反应中反应物与生成物的气体分子数关系,依据平衡移动原理,可得出提高NO2转化率的措施。图中采集的数据是反应进行相同时间后测得,温度低反应速率慢,所以温度低时反应未达平衡,温度高时反应已达平衡,由平衡后温度对反应物转化率的影响,可判断反应的ΔH与0的关系。
(1)①在T2温度下,0~2 s内c(CO2)=0.1mol/L,则依据浓度变化量之比等于化学计量数之比,可得出c(N2)= 0.05mol/L,反应速率v(N2)=![]() =0.025mol /(L·s)。答案为:0.025;
=0.025mol /(L·s)。答案为:0.025;
②由图中可以看出,温度为T1时先达平衡,所以T1>T2,降低温度CO2的转化率大,即降温平衡正向移动,所以该反应的ΔH<0。答案为:<;
(2)①A.加入催化剂,平衡不发生移动,NO2转化率不变,A不合题意;
B.降低温度,平衡正向移动,NO2转化率增大,B符合题意;
C.减小投料比[![]() ],相当于增大n(CH4),平衡正向移动,NO2转化率增大,C符合题意;
],相当于增大n(CH4),平衡正向移动,NO2转化率增大,C符合题意;
D.增大压强,平衡逆向移动,NO2转化率减小,D不合题意;
故选BC。答案为:BC;
②温度低反应速率慢,NOx的转化率小,随着温度的不断升高,反应速率加快,NOx的转化率增大,反应达平衡后,再升高温度,从曲线中才能真正看出平衡受温度的影响情况。
结论一:在250~450 ℃时,NOx转化率随温度升高而增大,说明反应未达平衡;450~600 ℃时NOx转化率随温度升高而减小,说明反应达平衡,且升高温度,NOx转化率减小,平衡逆向移动。推测原因是:在250~450℃时,反应未达到平衡,温度升高反应正向进行,NOx转化率随温度升高而增大;450~600℃(温度较高)时,反应已达平衡,所以,温度升高平衡向逆反应方向移动,NOx转化率随温度升高而减小。
结论二:比较两条曲线,可看出NO2的转化率大,则相同温度下NO的转化率比NO2的低。答案为:在250~450℃时,反应未达到平衡,温度升高反应正向进行,NOx转化率随温度升高而增大;450~600℃(温度较高)时,反应已达平衡,所以,温度升高平衡向逆反应方向移动,NOx转化率随温度升高而减小;相同温度下NO的转化率比NO2的低。


科目:高中化学 来源: 题型:
【题目】铁粉与水蒸气反应的装置如图所示,有关该反应的说法正确的是( )
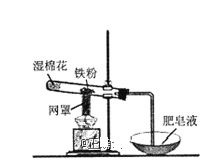
A.该反应属于复分解反应
B.网罩的作用是集中火焰,提高温度
C.湿棉花的作用是给试管降温,防止炸裂
D.铁与水蒸气在高温下的反应产物为Fe2O3和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸厂常用以下方法处理尾气:
(1)碱液吸收法:用![]() 溶液吸收
溶液吸收![]() 生成
生成![]() ,若取
,若取![]() 和足量
和足量![]() 溶液完全反应时转移电子数为
溶液完全反应时转移电子数为![]() ,该反应的离子方程式是______。
,该反应的离子方程式是______。
(2)氨催化吸收法,原理是![]() 与
与![]() 反应生成无毒的物质。某同学采用如图装置和步骤模拟工业上氮的氧化物处理过程:
反应生成无毒的物质。某同学采用如图装置和步骤模拟工业上氮的氧化物处理过程:
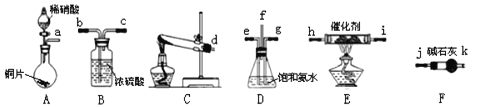
利用上述仪器,按如图流程图连接成模拟尾气处理装置:
![]()
①管口f接管口______。
②D装置的作用是______,用饱和氨水而不用纯水的目的是______。
③E装置中发生反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
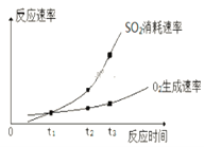
①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。
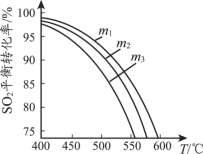
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,试回答下列问题:
(1)某处碳循环如图所示,CaCO3转化为HCO3-的离子方程式为_____________。

(2)常温常压下,空气中的CO2溶于水,达到平衡时,无机碳在浓液中以4种形式存在,其转化关系如下:
①CO2(g)+H2O![]() H2CO3 K=10-2.8
H2CO3 K=10-2.8
②H2CO3![]() H++HCO3- K1=10-3.5,
H++HCO3- K1=10-3.5,
③HCO3-![]() H++CO32- K2=10-10.3,
H++CO32- K2=10-10.3,
若溶液中。c(CO2)=1.0×10-5mol/L,且忽略水的电离及H2CO3的第二级电离,则溶液pH=_____。
(3)某化学小组为了测量湖水中无机碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,将吸收液用0.10mol/L盐酸滴定,生成的V(CO2)随V (盐酸)变化关系如图2所示,则吸收液中离子浓度由大到小的顺序为______________(不用写出H+),湖水中无机碳的浓度为_______mol/L。

(4)—定条件下,CO2和H2O可以转化为CO和H2,通过反应:CO(g)+2H2(g) ![]() CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。
CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。

①P1__P2(填“大于”、“小于”或“等于”);
②该反应在195℃、P2条件下达到平衡后,c(H2)=0.5 mol/L ,则该反应的平衡常数为______。
③已知CH3OH和CO的燃烧热分别725.8kJ/mol、283.0 kJ/mol,1mol液态水变成气态水吸热44.0kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_________________。
(5)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图4,则c电极的反应方程式为:_______________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置分别完成相关实验,能达到实验目的是![]()
A | B | C | D |
制备并收集氨气 | 比较 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中S原子和氟原子均满足最外层8电子稳定结构
D.SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.为了提高能源的利用率,各国都加大了能源开采力度
B.冰箱冷冻室中的食品可以长期保存而不变质
C.水晶是熔融态二氧化硅缓慢冷却形成的,而玛瑙则是热液快速冷却而形成的,主要成分都是![]()
D.将废旧塑料回收后可以加工成燃料,以补充能源和防止白色污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com