
【题目】某温度下,向一定体积0.1mol/L氨水中逐滴加入相同浓度的盐酸,溶液中pH与pOH的变化关系如图所示。下列说法错误的是( )

A.此温度下,水的离子积常数为1.0×10-2a
B.N点溶液加水稀释,![]() 增大
增大
C.M、Q、N三点所示的溶液中均存在:c(NH![]() )+c(H+)=c(OH-)+c(Cl-)
)+c(H+)=c(OH-)+c(Cl-)
D.Q点消耗的盐酸的体积等于氨水的体积
【答案】D
【解析】
A.Q点溶液中pOH=pH,c(H+)=c(OH-)=10-amol/L,溶液呈中性,此时氢离子浓度和氢氧根浓度乘积即为该温度下的离子积常数,为1.0×10-2a,故A正确;
B.一水合氨的电离平衡常数Kb=![]() ,所以
,所以![]() =
=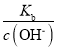 ,N点溶液pOH<pH,所以c(H+)<c(OH-),溶液显碱性,加水稀释溶液碱性减弱,所以c(OH-)减小,电离平衡常数不变,则
,N点溶液pOH<pH,所以c(H+)<c(OH-),溶液显碱性,加水稀释溶液碱性减弱,所以c(OH-)减小,电离平衡常数不变,则![]() 增大,故B正确;
增大,故B正确;
C.M、Q、N三点所示的溶液中均存在电荷守恒,即c(NH![]() )+c(H+)=c(OH-)+c(Cl-),故C正确;
)+c(H+)=c(OH-)+c(Cl-),故C正确;
D.氨水和盐酸浓度相同,若等体积混合,溶质为氯化铵,溶液显酸性,而Q点溶液呈中性,所以氨水的体积要稍大于盐酸的体积,故D错误;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高炉炼铁的一个反应如下: CO(g)+FeO(s)![]() CO2(g)+Fe(s),△H>0已知1100℃时K=0.263
CO2(g)+Fe(s),△H>0已知1100℃时K=0.263
(1)其平衡常数的表达式为K=___。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值___(填“增大”“减小”或“不变”下同),平衡常数K的变化是___。如果温度不变,在原平衡体系中继续加入一定量CO,达新平衡时,CO的体积分数和原平衡相比___。
(2)1100℃时,若测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应___(填“已经”或“没有”)处于化学平衡状态,此时化学反应速率是v(正)___(填“大于”“小于”或“等于”)v(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】打印机使用的墨粉中含有Fe3O4。它的一种制备方法是:将FeSO4溶液、Fe2(SO4)3溶液按一定比例混合,再加入一定量的NaOH溶液,水浴加热。反应如下:
反应a:![]()
下列分析不正确的是
A.Fe3O4具有磁性
B.反应a中,Fe2+ 是还原剂,Fe3+ 是氧化剂
C.从左至右,反应a各物质的系数依次为1、2、8、1、4
D.Fe3O4与盐酸反应,生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图所示。下列有关白屈菜酸的说法中不正确的是( )

A.白屈菜酸的同分异构体中可能含有芳香族化合物
B.所有碳原子可以共面
C.1mol白屈菜酸完全燃烧需要O2的物质的量为4mol
D.能通过加聚反应形成高分子物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如下。

已知:H3PO4能电离出PO43-。
(1)Li在元素周期表中的位置是________。
(2)LiFePO4中,铁元素的化合价为________价。
(3)将反应Ⅰ补充完整:____Fe2+ + 2H+ + ____H2O2 =____Fe3+ + 2H2O 。____
(4)反应Ⅲ的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
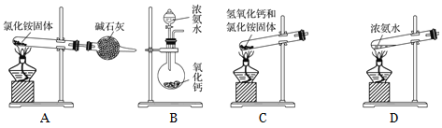
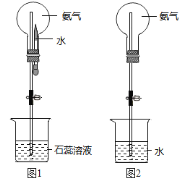
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(8)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(9)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com