
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
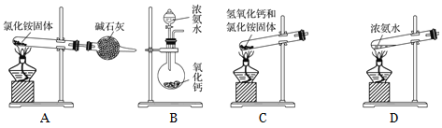
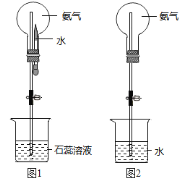
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(8)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(9)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
【答案】![]() D
D ![]() A
A ![]() Ca(OH)2+2NH4Cl
Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O AC NH3H2O
CaCl2+2NH3↑+2H2O AC NH3H2O![]() NH4++OH 打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉 氨气 加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体
NH4++OH 打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉 氨气 加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体
【解析】
(1)氮原子的核电荷数是7;
(2)氮气分子为两个氮原子通过共用3对电子形成共价键,该N≡N非常稳定,破坏需要吸收很高的能量,据此解答;
(3)N2分子中存在氮氮叁键,将空气中的氮气转化为氮的化合物的过程称为固氮,结合氨元素的形态变化判断即可;
(4)氨气是共价化合物,存在3个N-H键;
(5)加热消石灰与氯化铵固体得氨气、氯化钙和水;
(6)A.NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl;
B.CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
C.固体加热制气体时,试管口应略向下倾斜;
D.根据浓氨水易挥发分析;
(7)氨气极易溶解于水生成NH3H2O,使烧瓶内压强迅速减小,形成喷泉;
(8)喷泉实验需形成明显的压力差;
(9)碳酸氢铵不稳定,易分解生成氨气;氨气能使湿润的红色石蕊试纸变蓝色。
(1)N原子核外有7个电子,核外电子排布是2、5,则N原子结构示意图为:![]() ;
;
(2)A.氮分子是双原子分子,但双原子分子组成的物质可能活泼,如Cl2,N2不容易反应与是否是双原子分子无关,故A错误;
B.氮元素的非金属性很强,原子获得电子能力强,氮气要参加反应,首先应该变为单个原子,因此不能证明氮气性质不活泼,故B错误;
C.氮原子的半径较小,原子获得电子能力强,与氮气性质不活泼无关,故C错误;
D.N2是双原子分子,2个N原子共用三对电子,断裂N≡N需要消耗很高的能量,因此氮气不容易参加化学反应,D故正确;
故答案是D;
(3)N2分子中2个N原子形成3个共价键,使每个N原子都达到稳定结构,所以N2的电子式:![]() ;将空气中的氮气转化为氮的化合物的过程称为固氮。
;将空气中的氮气转化为氮的化合物的过程称为固氮。
A.N2和H2在一定条件下反应生成NH3,氮元素的单质变为化合物,属于人工固氮,故A正确;
B.雷雨闪电时空气中的N2和O2化合生成NO,氮元素的单质变为化合物,属于氮的固定,是自然固氮,故B错误;
C.NH3经过催化氧化生成NO,是N元素的化合物的转化,不是氮的固定,故C错误;
D.NH3和HNO3反应生成NH4NO3,是N元素的化合物的转化,不是氮的固定,故D错误;
故答案为A;
(4)在NH3中,N原子最外层有5个电子,N原子与三个H原子形成3个共价键,从而使每个原子都达到稳定结构,NH3的电子式:结合形成NH3,所以NH3的电子式为![]() ;
;
(5)消石灰与氯化铵固体混合加热产生氨气、氯化钙和水,此反应的化学方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(6)A.氯化铵不稳定受热易分解,但是氨气与氯化氢遇冷又极易反应生成氯化铵固体,不能用于制备氨气,故A错误;
B.向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,有利于浓氨水中的氨气逸出,故B正确;
C.固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,所以利用氯化铵和氢氧化钙固体加热制取氨气需试管口应略向下倾斜,故C错误;
D.浓氨水易挥发,加热能够促进氨气的逸出,可以用来制备氨气,故D正确;
故答案为AC;
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,当挤压滴管的胶头时,水进入烧瓶中,氨气溶于水,使烧瓶内气体压强减小,烧杯内的水不断进入烧瓶,由于氨气溶于形成的一水合氨电离产生NH4+、OH,水溶液显碱性,因此可以得到红色喷泉,用方程式表示为:NH3H2O![]() NH4++OH;
NH4++OH;
(8)如果只提供如图2的装置,引发喷泉的方法是打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,再将热源移开,水进入烧瓶内,氨气溶解于水中产生压强差,即发生喷泉;
(9)NH4NO3是常用的铵态氮肥,在施用时若受热,就会发生分解反应释放出氨气而降低肥效;检验NH4+的方法是加入强碱反应,加热能够产生使湿润的红色石蕊试液变蓝的刺激性气体。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol雄黄(As4S4, )中共有4NA个共价键
)中共有4NA个共价键
B.通过核反应![]() Am+
Am+![]() Ca→288Mc+3
Ca→288Mc+3![]() n生成2.88 g镆(Mc),同时产生中子(n)数为0.3NA
n生成2.88 g镆(Mc),同时产生中子(n)数为0.3NA
C.100 g 3.4%的过氧化氢溶液中氧原子数为0.2NA
D.常温常压下,2.8 g由CO与N2组成的混合物中含有的质子总数为1.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L氨水中逐滴加入相同浓度的盐酸,溶液中pH与pOH的变化关系如图所示。下列说法错误的是( )

A.此温度下,水的离子积常数为1.0×10-2a
B.N点溶液加水稀释,![]() 增大
增大
C.M、Q、N三点所示的溶液中均存在:c(NH![]() )+c(H+)=c(OH-)+c(Cl-)
)+c(H+)=c(OH-)+c(Cl-)
D.Q点消耗的盐酸的体积等于氨水的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。完成下列填空:
(1)砷原子核外有____个电子层,最外层有_____个电子。
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列_____(用元素符号表示)
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:_____强于____(填物质的化学式)
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空,5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程。如图:
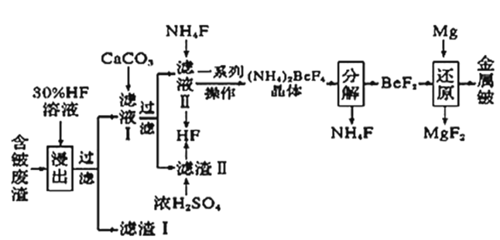
已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有___、__(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:__。
(2)该流程中可循环利用的物质是__;滤渣Ⅱ与浓硫酸发生反应的化学方程式为___;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指__过滤、洗涤、干燥。
(3)“分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为___;“还原”过程可以用金属镁制备金属铍的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g的氧化铝溶于一定浓度的500mL 的盐酸中,充分反应后,再逐滴加入0.5mol/L 的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
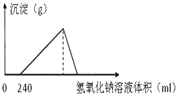
(1)最大沉淀的质量。_______
(2)沉淀最大时耗用多少毫升氢氧化钠溶液?______
(3)当沉淀从最大值到恰好完全消失时,耗用多少毫升的氢氧化钠溶液?______
(4)原盐酸溶液的物质的量浓度是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】门捷列夫发现化学元素的周期性,依照原子量,制作出世界上第一张元素周期表,并据以预见了一些尚未发现的元素。
完成下列填空:

(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。___
(2)在上表标出的①一⑦号元素中,可以形成化合物种类最多的是___(请填写元素符号,下同),通常情况下不易与其他物质发生反应的是___。
(3)元素1与元素2金属性较强的是___(填元素符号),请解释理由__。
(4)下列事实可以用来判断元素5与6的非金属性强弱的是____。(填序号)
A.两种元素气态氢化物的沸点高低
B.两种元素形成的化合物中元素5显正价
C.两种元素最高价氧化物对应水化物的酸性强弱
D.元素6单质能将元素5从它的氢化物中置换出来
(5)锡(Sn)是很早便被发现和使用的金属,其原子结构示意图见图。

请在上表相应位置填入锡的元素符号。___。
(6)SnO2能与NaOH反应生成钠盐,写出反应的化学方程式___,这个反应可以说明锡元素具有____(填“金属性”或“非金属性”)。锡溶于盐酸得到溶液A,向A中通入氯气,氯气被还原。写出在A中反应的化学方程式____。
(7)解释表中卤化锡的熔、沸点的变化规律___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,1 g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C.2CH3OH+3O2=2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com