
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。完成下列填空:
(1)砷原子核外有____个电子层,最外层有_____个电子。
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列_____(用元素符号表示)
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:_____强于____(填物质的化学式)
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因______。
【答案】4 5 N<P<As HBrO4 H3AsO4 Al(OH)3 ![]() H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解
H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解
【解析】
(1)砷(AS)是第四周期ⅤA族元素,依据周期序数等于电子层数,最外层电子数等于主族序数,所以砷原子核外有4个电子层,最外层有5个电子;
故答案为:4;5;
(2)同主族元素原子从上到下原子半径依次增大,所以按从小到大的顺序排列N<P<As;
故答案为:N<P<As;
(3)溴与砷同周期,位于ⅧA族,同周期元素从左到右非金属性依次增强,溴、砷最高价氧化物对应水化物酸性的强弱HBrO4强于H3AsO4,
故答案为:HBrO4;H3AsO4;
(4)周期表中,铝和砷都在金属和非金属过渡线附近,具有非金属性:如氢氧化铝和碱溶液反应,氢氧化铝存在酸式电离,Al(OH)3![]() H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解,
H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和平衡向右移动,Al(OH)3溶解,
故答案为:氢氧化铝存在酸式电离,Al(OH)3![]() H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和,平衡向右移动,Al(OH)3溶解。
H++AlO2-+H2O,加入NaOH溶液,OH-与H+中和,平衡向右移动,Al(OH)3溶解。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】下列数据是对应物质的熔点,有关的判断错误的是( )
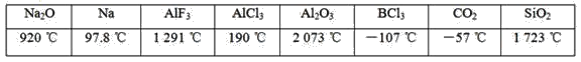
A.含有金属阳离子的晶体不一定是离子晶体
B.同族元素的氧化物可形成不同类型的晶体
C.活泼金属元素与活泼非金属元素一定能形成离子化合物
D.金属晶体的熔点不一定比分子晶体的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】打印机使用的墨粉中含有Fe3O4。它的一种制备方法是:将FeSO4溶液、Fe2(SO4)3溶液按一定比例混合,再加入一定量的NaOH溶液,水浴加热。反应如下:
反应a:![]()
下列分析不正确的是
A.Fe3O4具有磁性
B.反应a中,Fe2+ 是还原剂,Fe3+ 是氧化剂
C.从左至右,反应a各物质的系数依次为1、2、8、1、4
D.Fe3O4与盐酸反应,生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如下。

已知:H3PO4能电离出PO43-。
(1)Li在元素周期表中的位置是________。
(2)LiFePO4中,铁元素的化合价为________价。
(3)将反应Ⅰ补充完整:____Fe2+ + 2H+ + ____H2O2 =____Fe3+ + 2H2O 。____
(4)反应Ⅲ的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL O2。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
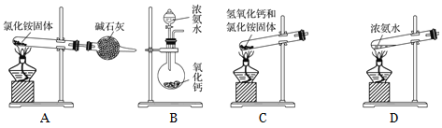
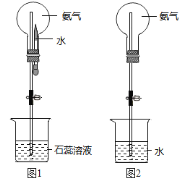
(7)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(8)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(9)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在工农业生产和日常生活中有广泛的应用,对其研究具有重要意义。
回答下列问题:
(1)利用活性炭的___作用可去除水中的悬浮杂质。
(2)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速将SO2氧化为SO3,其活化过程中的能量变化如图所示:
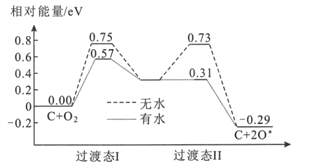
活化过程中有水时的活化能降低了___eV。在酸雨的形成过程中,炭黑起:___作用。
(3)已知:CO(g)+2H2(g)![]() CH3OH(g) H,经测定不同温度下该反应的浓度平衡常数如下:
CH3OH(g) H,经测定不同温度下该反应的浓度平衡常数如下:

①该反应的△H___0(填“>”或“<");250℃时,某时刻测得反应体系中c(CO)=0.4mol·L-1、c(H2)=0.4mol·L-1、c(CH3OH)=0.8mol·L-1,则此时v正__v逆(填“>”、“=”或“<”)。.
②某温度下,在2L刚性容器中,充入0.8molCO和1.6molH2,压强为p,tmin后达到平衡,测得压强为![]() P。则v(H2)=____mol·L-1·min-1,平衡时的Kp=____。
P。则v(H2)=____mol·L-1·min-1,平衡时的Kp=____。
(4)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
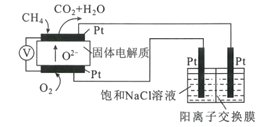
①该电池工作时负极反应方程式为____。
②用该电池电解100mL饱和食盐水,若在两极产生的气体体积分别为V1L、V2L(标准状况),且V1>V2,则电解所得溶液的c(OH-)=____mol·L-1(忽略气体溶解和溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国在天然气脱硫研究方面取得了新进展,利用如图1装置可完成天然气脱硫,甲池中发生反应如图2所示。


下列关于该装置工作原理的说法中,正确的是( )
A.碳棒为该脱硫装置的负极
B.乙池中发生的反应为:H2S+2e-=S+2H+
C.AQ与H2AQ间的转化属于非氧化还原反应
D.除I![]() /I-外,Fe3+/Fe2+也能实现如图所示循环过程
/I-外,Fe3+/Fe2+也能实现如图所示循环过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com