
【题目】近年来我国在天然气脱硫研究方面取得了新进展,利用如图1装置可完成天然气脱硫,甲池中发生反应如图2所示。


下列关于该装置工作原理的说法中,正确的是( )
A.碳棒为该脱硫装置的负极
B.乙池中发生的反应为:H2S+2e-=S+2H+
C.AQ与H2AQ间的转化属于非氧化还原反应
D.除I![]() /I-外,Fe3+/Fe2+也能实现如图所示循环过程
/I-外,Fe3+/Fe2+也能实现如图所示循环过程
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。完成下列填空:
(1)砷原子核外有____个电子层,最外层有_____个电子。
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列_____(用元素符号表示)
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:_____强于____(填物质的化学式)
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应mA(s)+nB(g) ![]() pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(B)=2v(C)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q的数值可以是 ( )
pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(B)=2v(C)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q的数值可以是 ( )
A.2、6、3、5B.3、2、1、1
C.1、1、1、1D.2、2、1、3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 N2(g)+3H2(g)![]() 2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
A.0.01mol·L-1B.0.02mol·L-1
C.0.05mol·L-1D.0.15mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,1 g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C.2CH3OH+3O2=2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:____min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②3~4min内以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积.他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量.你认为不可行的是____(填字母)。
A 蒸馏水 B KCl洛液 C 浓盐酸 D CuSO4溶液
(3)在4L密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图。

①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是___________(填字母)。
A Y的体积分数在混合气体中保持不变 B X,、Y的反应速率比为3:1
C 容器内气体压强保持不变 D 容器内气体的总质量保持不变
E 生成1molY的同时消耗2molZ
③2min内Y的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铁与稀硝酸反应产生一氧化氮,某校兴趣小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球。
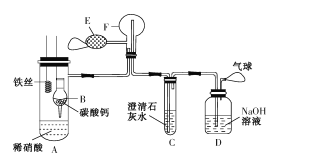
回答下列问题:
(l)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,一段时间后,C中澄清石灰水____(填现象)时,将B装置上提,使之与稀硝酸分离。
(2)将A中铁丝放入稀硝酸中,装置A中产生________(填“无色”或“红棕色”)气体。用E向F中鼓入空气后,烧瓶F内发生反应的化学方程式为 ___, 一段时间后,C中的现象为____。
(3)若反应后向A中溶液滴加KSCN溶液,溶液不变红色,则铁丝与稀硝酸反应的离子方程式为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com