
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。
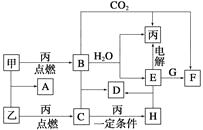
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C—→D的化学方程式:__________________________________;
写出E+G—→F的离子方程式:____________________________________。
【答案】 O 2 SO 3 ![]() 增强溶液的导电能力 Na 2 O 2 +SO 2 ===Na 2 SO 4 OH - +HCO 3 - ===CO 3 2- +H 2 O
增强溶液的导电能力 Na 2 O 2 +SO 2 ===Na 2 SO 4 OH - +HCO 3 - ===CO 3 2- +H 2 O
【解析】
甲、乙、丙为常见单质,A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,均含有Na元素,B能与二氧化碳、水反应生成单质丙,则B为Na2O2,丙为O2,甲为Na,E为NaOH,F为Na2CO3,G的焰色反应为黄色,与氢氧化钠反应得到碳酸钠,判断G为NaHCO3;C能使品红溶液褪色,由单质乙与氧气反应得到,则乙为S,A为Na2S,C为SO2,H为SO3,D为Na2SO4,据此解答。
根据上述分析,甲为Na,乙为S,丙为O2,A为Na2S,B为Na2O2,C为SO2,D为Na2SO4,E为NaOH,F为Na2CO3,G为NaHCO3,H为SO3。
(1)丙为O2,H为SO3,故答案为:O2;SO3;
(2)A为Na2S,属于离子化合物,电子式为 ![]() ,故答案为:
,故答案为:![]() ;
;
(3)电解NaOH的水溶液时,实质是电解水,NaOH起到的作用是:增强溶液导电能力,故答案为:增强溶液导电能力;
(4)B+C→D是过氧化钠与二氧化硫反应生成硫酸钠,反应化学方程式为:Na2O2+SO2=Na2SO4;E和G是氢氧化钠和碳酸氢钠溶液的反应,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,故答案为:Na2O2+SO2=Na2SO4;HCO3-+OH-=CO32-+H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述或数据正确的是( )
A. 用广泛pH试纸测得某溶液的pH为2.3
B. 酸碱中和滴定实验中,锥形瓶必须用待测液润洗
C. 用已知浓度的盐酸滴定未知浓度的NaOH溶液时,若读取标准液读数时,滴前仰视,滴定到终点后俯视,会导致测定结果偏低
D. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
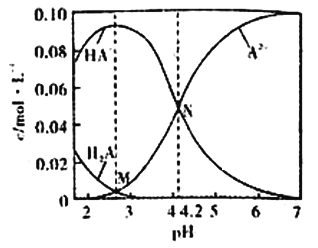
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
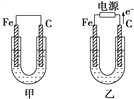
(1)若两池中电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:______________________________________
②甲池中碳极上电极反应式是_______________________________________,
乙池中碳极上电极反应属于________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存于同一溶液中的是 ( )。
A.CO32-. H + . Na + . NO3-B.H + . Ag+ . Cl-. SO42-
C.K+ . Na + . OH- .NO 3-D.Ba2+ .Ca 2+ .SO42- . OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.生石灰、白磷、冰水混合物
B.烧碱、液氧、碘酒
C.干冰、铁、氯化氢
D.纯碱、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。

(1)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:___________________________________,__________________________________(写出2条);
(2)写出反应①的离子方程式_______________________________________________;
(3)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图建议最合适的氯化铵系数和温度:氯化铵系数为___________,温度为_____________;

(4)反应②发生后,溶液中的氯元素以Cl-的形式存在,请写出反应②的化学方程式__________________________________________________________________;
(5)查阅资料得知:NH4VO3也叫偏钒酸铵,其相对分子量为117,20℃时,NH4VO3溶解度为0.468g,已知离子交换后溶液中c(VO3-)=0.10mol/L,反应③沉矾时,加入等体积0.10mol/L的NH4Cl溶液,通过列式计算判断此时是否有NH4VO3沉淀析出?(溶液体积变化忽略不计)____________
(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅晶体是信息技术的重要材料。
(1)工业上用石英和焦炭可以制得粗硅。已知反应过程的能量变化如下图


写出用石英和焦炭制取粗硅的热化学方程式______________________________。
(2)某同学设计下列流程制备高纯硅:

①Y的化学式为____________________。
②写出反应I的离子方程式________________________________________。
③写出反应IV的化学方程式________________________________________。
④甲烷分解的温度远远高于硅烷(SiH4),用原子结构解释其原因______________________。
(3)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。

A.该反应是放热反应
B.横坐标表示的投料比可以是![]()
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com