
【题目】下列物质属于纯净物的是
A. 精盐 B. 蒸馏水 C. 盐酸 D. 漂白粉
科目:高中化学 来源: 题型:
【题目】以下反应不符合绿色化学原子经济性要求的是( )
A. ![]() +HCl→CH2=CHCl
+HCl→CH2=CHCl
B. CH2=CH2+1/2O2![]()
![]()
C. ![]() +Br2
+Br2![]() +HBr
+HBr
D. CH2=CH2+HCl→CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1∶3∶2;
⑥混合气体的平均相对分子质量不变
A. ②④⑤ B. ①③④⑥ C. ①②④⑥ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是 ( )
A.制备溴苯时,将苯与溴水混合,剧烈振荡
B.除去甲烷中混有的二氧化碳时,依次通过烧碱溶液和浓硫酸
C.在酸性高锰酸钾溶液中滴加几滴苯,用力振荡,紫红色褪去
D.在苯中通氢气制备环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答下列问题。

(1)该原电池外电路中电流方向:锌_________铜(填“→”或“←”)。
(2)该原电池中_________电极(写出电极材料名称)产生无色气泡,写出该电极反应式:________;该电极发生 ______________反应(填“氧化”或“还原”)。当电路中通过0.2mol电子时,该电极上产生的气体在标准状况下的体积为_________L。
(3)一段时间后,烧杯中溶液的pH_____________(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
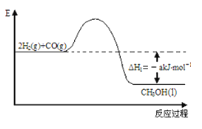
CO的燃烧热△H2=-b kJ/mol,CH3OH的燃烧热△H3=-c kJ/mol。请根据以上信息,回答下列有关问题:
(1)甲醇是一种______(填“可”或“不可”)再生能源,甲醇的官能团的电子式是____________。
(2)CH3OH燃烧热的热化学反应方程式为___________________________________。
(3)H2的燃烧热△H=_______________________。
(4)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据算出b=_______(用d、e、f的代数式表示)。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
(6)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9kJ/mol,NO(g)+1/2O2(g)=NO2(g) ΔH=-58.2kJ/mol,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH=-241.6kJ/mol,反应3NO(g)+O3(g)==3NO2(g)的ΔH=________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是( )
A. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
B. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡: NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入2 mol SO2、1 mol O2,向乙中充入4mol SO2、2 mol O2。甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,.关闭活塞K,使两容器中各自发生下述反应:2 SO2(g)+O2(g)![]() 2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
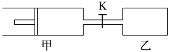
A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间.再次达到平衡.甲的体积为1.4 L
D.平衡后向甲中再充入2mol SO2、1mol O2和3moLSO3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com