
【题目】电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示。
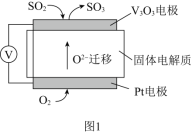
①固体电解质中O2-向______极移动(填“正”或“负”)。
②写出V2O5电极的电极反应式:_____________。
(2)近期科学家研究发现微生物可将生产废水中的尿素[CO(NH2)2]直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
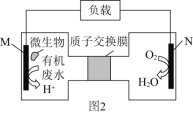
①N极为____极(填“正”或“负”),M电极反应式______________________。
②N极消耗标准状况下33.6L气体时,M极理论上处理的尿素的质量为______g。
(3)人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是__________。
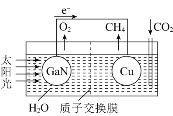
A.该装置为原电池,且铜为正极
B.电池工作时,H+向Cu电极移动
C.GaN电极表面的电极反应式为2H2O-4e-=O2+4H+
D.反应CO2+2H2O![]() CH4+2O2中每消耗1molCO2转移4mole-
CH4+2O2中每消耗1molCO2转移4mole-
【答案】负 SO2-2e-+O2-=SO3 正 CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+ 60 D
【解析】
(1)根据图像,原电池内电路,阴离子向负极移动;
(2)N电极氧气变为水,化合价降低,得电子为正极;
(3)该装置无外加电源,为原电池,铜极上C的化合价降低,得电子,为正极。
(1)根据图像,原电池内电路,阴离子向负极移动,固体电解质中O2-向负极移动,Pt电极为正极:O2+4e-=2O2-,则V2O5电极为负极:SO2-2e-+O2-=SO3;
(2)N电极氧气变为水,化合价降低,得电子为正极,反应式为O2↑+4H++4e-=2H2O,M为负极:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+;N极消耗标准状况下33.6L气体时,即消耗1.5mol的O2,得处理![]() =1mol的尿素,即60g的尿素;
=1mol的尿素,即60g的尿素;
(3)A.该装置无外加电源,为原电池,铜极上C的化合价降低,得电子,为正极,与题意不符,A不选;
B.电池工作时,H+为阳离子,向正极移动,即向Cu电极移动,与题意不符,B不选;
C.GaN电极为负极,失电子,表面的电极反应式为2H2O-4e-=O2↑+4H+,与题意不符,C不选;
D.反应CO2+2H2O![]() CH4+2O2中每消耗1molCO2化合价由+4变为-4,转移8mole-,符合题意,D选;
CH4+2O2中每消耗1molCO2化合价由+4变为-4,转移8mole-,符合题意,D选;
答案为D。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B.2.8gCO与C2H4的混合气体中所含分子数为0.1NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.含1molFeCl3的氯化铁溶液完全水解生成Fe(OH)3胶体,其中胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池的研究已成为治理和消除环境污染的重要课题,其工作原理如图所示![]() 、B、M、N均为惰性电极
、B、M、N均为惰性电极![]() 。下列说法正确的是
。下列说法正确的是
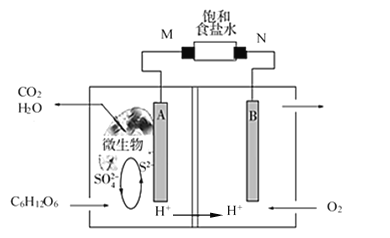
A.该电池负极区发生一个化学反应
B.M电极附近产生黄绿色气体
C.消耗![]() 时转移
时转移![]()
D.升高温度一定能增大电流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在A处通入未经干燥的氯气。当关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C处的红布条逐渐褪色。则D瓶中盛放的溶液不可能是( )
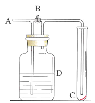
A.饱和NaCl溶液B.NaOH溶液C.NaBr溶液D.浓H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。

(1)A的结构式为__________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①____________________________________反应类型:__________。
②_____________________________________反应类型:__________。
(3)实验室怎样鉴别B和D?_________________________。
(4)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为_______,该溶液的主要作用是_____________________________________;
(5)该装置图中有一个明显的错误是_____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.被氧化和被还原的离子数目比为![]()
B.该反应说明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 发生氧化反应,转移
发生氧化反应,转移![]()
D.若利用该反应设计原电池,则负极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
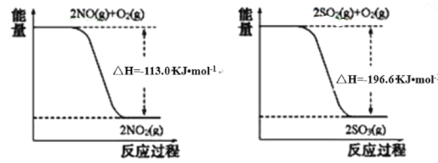
(1)写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式_____________。
(2)常温下用NaOH溶液吸收SO2,当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,利用图所示装置(电极均为惰性电极)在pH为4~7之间电解,可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸,这是电化学脱硫技术之一,
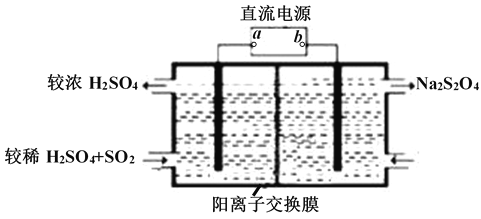
①a为电源的_______(填 “正极”或“负极”);
②阴极的电极反应式为______
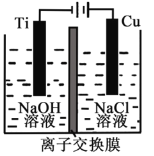
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,反应为2Cu + H2O ==Cu2O + H2↑。装置如图所示:该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:____________________,钛极附近的pH_______ (增大、减小、不变)。
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
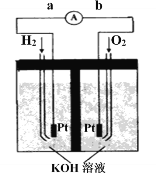
①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为_______(用a→b或b→a表示)。
②负极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应的化学方程式书写正确是
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.![]()
C.CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+ H2O
CH3COOCH2CH3+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com