
����Ŀ����.NOx��CO��SO2�ȴ�����Ⱦ����Ĵ�������������������о����ȵ����⡣
��1����֪��
a.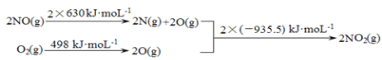
b.2NO��g����O2��g��![]() 2NO2��g�� ��H1
2NO2��g�� ��H1
2SO2��g����O2��g��![]() 2SO3��g�� ��H2=��196.6 kJ��mol-1
2SO3��g�� ��H2=��196.6 kJ��mol-1
����H1 =___kJ��mol-1��
��д��NO2������SO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽ____��
��2��ú̿ȼ�չ����в�����CO�ֻ���CaSO4������ѧ��Ӧ������������Ч�ʡ�������������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��Ӧ��CaSO4��s����CO��g��![]() CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
��Ӧ��CaSO4��s����4CO��g��![]() CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
�����ϣ��ٷ�Ӧ��ͷ�Ӧ��ͬʱ�������ڷ�Ӧ������ʴ��ڷ�Ӧ������ʣ�
��ش��������⣺
�����з�Ӧ���������仯ʾ��ͼ��ȷ����____��
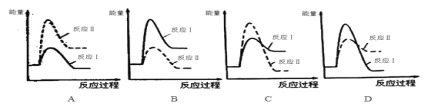
��.���淴ӦmA(g)��nB(g)![]() pC(g)��gD(g)��v��tͼ����ͼ����ʾ���������������䣬ֻ�ڷ�Ӧǰ������ʵĴ�������v��tͼ��������ʾ������˵����ȷ����___��
pC(g)��gD(g)��v��tͼ����ͼ����ʾ���������������䣬ֻ�ڷ�Ӧǰ������ʵĴ�������v��tͼ��������ʾ������˵����ȷ����___��
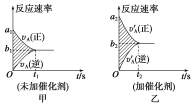
��a1��a2 ��a1��a2 ��b1��b2 ��b1��b2 ��t1��t2 ��t1��t2 ����ͼ����Ӱ���������� ��ͼ������Ӱ�����������
��.��0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����
2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����
T/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
��ش�����������
���ԱȽ�K1��K2�Ĵ�С��K1____K2(�������=������)��
��400��ʱ����Ӧ2NH3(g)![]() N2(g)+3H2(g)��ƽ�ⳣ��KΪ____�������NH3��N2��H2��Ũ�ȷֱ�Ϊ3molL1��2molL1��1molL1ʱ����÷�Ӧ��v��(N2)___v��(N2)(�������=������)��
N2(g)+3H2(g)��ƽ�ⳣ��KΪ____�������NH3��N2��H2��Ũ�ȷֱ�Ϊ3molL1��2molL1��1molL1ʱ����÷�Ӧ��v��(N2)___v��(N2)(�������=������)��
���𰸡���113 NO2��g����SO2��g��![]() SO3��g����NO��g�� ��H=��41.8kJ��mol-1 C �ڢܢݢ� �� 2 ��
SO3��g����NO��g�� ��H=��41.8kJ��mol-1 C �ڢܢݢ� �� 2 ��
��������
��1���ٷ�Ӧ�ȵ��ڷ�Ӧ���м���֮�����������м���֮�͵IJ�ֵ������H1ͨ��ͼ����ʾ��֪Ӧ���ǣ�2��630+498��2��935.5��kJ��mol-1��-113 kJ��mol-1��
����֪��2NO��g����O2��g��![]() 2NO2��g�� ��H1��-113 kJ��mol-1
2NO2��g�� ��H1��-113 kJ��mol-1
2SO2��g����O2��g��![]() 2SO3��g�� ��H2=��196.6 kJ��mol-1
2SO3��g�� ��H2=��196.6 kJ��mol-1
���ݸ�˹���ɺ���ȥǰ���õ�NO2��g����SO2��g��![]() SO3��g����NO��g����H=��83.6kJ��mol-1�������Ȼ�ѧ����ʽΪNO2��g����SO2��g��
SO3��g����NO��g����H=��83.6kJ��mol-1�������Ȼ�ѧ����ʽΪNO2��g����SO2��g��![]() SO3��g����NO��g�� ��H=��41.8kJ��mol-1��
SO3��g����NO��g�� ��H=��41.8kJ��mol-1��
��2����.���ݻ��ԽС��ѧ��Ӧ����Խ�͵��ص㣬��Ϊ��Ӧ������ʴ��ڷ�Ӧ������ʣ�ͬʱ��Ӧ��Ϊ���ȷ�Ӧ����Ӧ��Ϊ���ȷ�Ӧ������ѡC��
��. ��Ϊ���˴�������ѧ��Ӧ���ʿ죬���Ԣ���ȷ�����˴�����ƽ��ʱ��ѧ��Ӧ����Ҳ�ӿ죬���Ԣ���ȷ����Ϊ���˴�������ѧ��Ӧ���ʼӿ죬ʱ���̣����Ԣ���ȷ���ߴ���ֻ�ı�����û�ı�ƽ�⣬����������ʱ��ij˻����䣬������Ӱ�����ȣ����Ԣ���ȷ��
��.�������¶Ⱥ�ƽ���������ƶ�����ѧƽ�ⳣ����С������K1��K2��
��400��ʱ����Ӧ2NH3(g)![]() N2(g)+3H2(g)��ƽ�ⳣ��KΪ����Ӧ�Ļ�ѧƽ�ⳣ���ĵ���������Ϊ
N2(g)+3H2(g)��ƽ�ⳣ��KΪ����Ӧ�Ļ�ѧƽ�ⳣ���ĵ���������Ϊ![]() =2�������ʱ������
=2�������ʱ������![]() ��2������ƽ���������ƶ�������v��(N2)��v��(N2)��
��2������ƽ���������ƶ�������v��(N2)��v��(N2)��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ����( )
A.���³�ѹ�£�1.06g Na2CO3���е�Na+������Ϊ0.01NA
B.��״���£�22.4L�ƾ����еķ�����ΪNA
C.�ڳ��³�ѹ�£�28gN2��CO����������������ķ�����Ŀһ��ΪNA
D.���ʵ���Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl-����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�Ӷ�O3�ķֽ��д����ã�
O3��Cl === ClO��O2����H1
ClO��O === Cl��O2����H2
����������ķֽⷴӦ��O3��O===2O2����H���÷�Ӧ�������仯��ͼ��
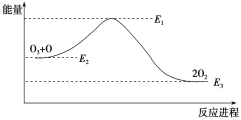
���������У���ȷ����(����)
A. ��ӦO3��O===2O2�Ħ�H��E1��E3
B. O3��O===2O2�����ȷ�Ӧ
C. ��H����H1����H2
D. 2O2===O3��O �Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����Ϊ2 L���ܱ�������X��Y��Z��������ij�ʼ���ʵ�����ƽ�����ʵ������±���
���� | X | Y | Z |
��ʼ���ʵ���/mol | 0.2 | 0.2 | 0 |
ƽ�����ʵ���/mol | 0.1 | 0.05 | 0.1 |
����˵����ȷ���ǣ� ��
A.��Ӧ�ɱ�ʾΪ![]() ����ƽ�ⳣ��Ϊ8 000
����ƽ�ⳣ��Ϊ8 000
B.����ѹǿʹƽ��������Z�ķ����ƶ�����ƽ�ⳣ������
C.�������������ѹ����1 L����X�����������С��Ũ������
D.�������¶ȣ�Z��Ũ���������¶�����ʱ![]() ������
������![]() ���С
���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.����A������Ԫ����ɵĻ����Ϊ̽������A����ɣ���Ʋ������ʵ�飺
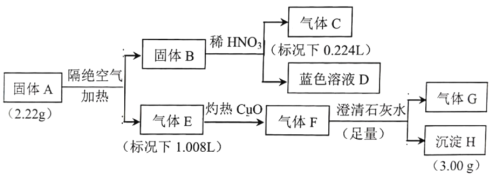
��֪������B��һ�ֵ��ʣ�����E��F����G������һ��������ɡ�
��ش�
��1�����A������Ԫ����__________������E��__________��
��2������A�����������ȷֽ�Ļ�ѧ����ʽ��__________��
��3����ɫ��ҺD���Ҵ���Ӧ�ɻ�ù���A��ͬʱ������һ�ֳ������������壬�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
��.ij��ѧ��ȤС��Ϊ̽��SO2��![]() ��Һ�ķ�Ӧ��������װ�ã��г֡����������ԣ�����ʵ�飺�Ʊ�SO2����SO2ͨ��
��Һ�ķ�Ӧ��������װ�ã��г֡����������ԣ�����ʵ�飺�Ʊ�SO2����SO2ͨ��![]() ��Һ�У�Ѹ�ٷ�Ӧ���õ���ɫ������Һ�Ͱ�ɫ������
��Һ�У�Ѹ�ٷ�Ӧ���õ���ɫ������Һ�Ͱ�ɫ������
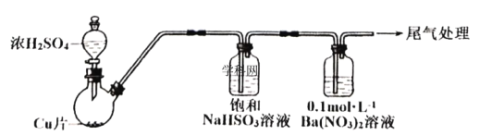
��1��SO2ͨ��![]() ��Һ�У��õ���ɫ������Һ�Ͱ�ɫ���������ӷ���ʽ��__________��
��Һ�У��õ���ɫ������Һ�Ͱ�ɫ���������ӷ���ʽ��__________��
��2����ͨ��![]() ��Һ�е�SO2�ѹ����������ʵ�鷽������__________��
��Һ�е�SO2�ѹ����������ʵ�鷽������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ײʱ����ȫ�����з�����Ӧ��10NaN3��2KNO3=K2O��5Na2O��16N2������˵����ȷ����(����)
A. KNO3�ǻ�ԭ�������е�Ԫ�ر�����
B. �������е�N2���������K2O�ǻ�ԭ����
C. ÿת��1 mol���ӣ�������N2�����Ϊ35.84 L
D. ����65 g NaN3�μӷ�Ӧ����������N�����ʵ���Ϊ3 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����䡰������ʱ���£�N2H4����Ϊ�����������ȼ�ϣ�NO2Ϊ����������Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g)=2NO2(g) ��H=+67.7kJ��mol-1 ��N2H4(g)+O2(g)= N2(g)+2H2O(g) ��H=-534kJ��mol-1���й����º�NO2��Ӧ���Ȼ�ѧ����ʽ�У���ȷ���ǣ� ��
A. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) ��H= -1135.7kJ��mol-1
B. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H= -1000.3kJ��mol-1
C. N2H4(g)+NO2(g)= ![]() N2(g)+2H2O(l) ��H= -500.15kJ��mol-1
N2(g)+2H2O(l) ��H= -500.15kJ��mol-1
D. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H= -1135.7kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A.��״���£�11.2L�����ԭ������ΪNA
B.���³�ѹ�£�14gN2���еķ�����Ϊ0.5NA
C.��״���£�6.72L�����к��еķ�����Ϊ0.3NA
D.���³�ѹ�£�9gH2O�к��е�ԭ������Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á��õ�صĵ������ҺΪKOH��Һ�����ij䡢�ŵ練Ӧ����ʽ���У�Cd��2NiOOH��2H2O![]() Cd(OH)2��2Ni(OH)2��������������ȷ���ǣ� ��
Cd(OH)2��2Ni(OH)2��������������ȷ���ǣ� ��
A.�ŵ�ʱ��������ӦΪCd��2e����2OH����Cd(OH)2
B.���ʱ��������������Һ��pH���ϱ�С
C.�ŵ�ʱ��ÿת��0.2mol���ӣ���0.1mol�������ϱ���ԭ
D.���ʱ��������ӦΪ2NiOOH��2e����2OH����2Ni(OH)2��2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com