
【题目】氯原子对O3的分解有催化作用:
O3+Cl === ClO+O2 ΔH1
ClO+O === Cl+O2 ΔH2
大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化如图:
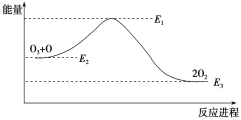
下列叙述中,正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. 2O2===O3+O 是放热反应
科目:高中化学 来源: 题型:
【题目】100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g)![]() 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。

Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____mol·L-1·s-1。
(2)根据图中有关数据,计算100℃时该反应的平衡常数K1=____。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1_____K2(填“>”、“<”或“=”)。
(3)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____。
A.降低温度 B.通入氦气 C.又往容器中充入N2O4 D.增大容器容积
(4)已知:N2(g)+2O2(g)![]() 2NO2(g) ΔH=+67.2kJ·mol-1
2NO2(g) ΔH=+67.2kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2O4(g)![]() 2NO2(g) ΔH=+57.0kJ·mol-1
2NO2(g) ΔH=+57.0kJ·mol-1
则2N2H4(g)+N2O4(g)![]() 3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
3N2(g)+4H2O(g) ΔH=____kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。
H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是____(填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1∶1∶1∶1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___(填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____(“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____。(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式中正确的是( )
A.盐酸与碳酸钙反应:CO32-+2H+=CO2↑+H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3- =CaCO3↓+H2O
C.氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.Ba(OH)2与稀H2SO4反应的离子方程式:H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在化学工业中有广泛的应用。根据如下工作原理图,下列说法正确的是
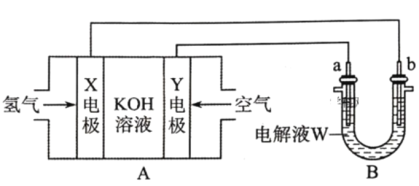
A.电极Y为正极,电极反应式为: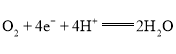
B.若W为饱和食盐水(滴有几滴酚酞溶液),则工作一段时间后a电极附近溶液变红
C.若a为粗铜(含Zn、Ag等杂质),W为CuSO4溶液,工作一段时间后![]() 减小
减小
D.若a为银棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.16g,则X电极消耗氢气0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对于反应:2HI(g)![]() H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.棕红色气体NO2(2NO2![]() N2O4)缩小体积加压后,颜色先变深后变浅
N2O4)缩小体积加压后,颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g)。2 min时测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1B. 2 min内A的反应速率为0.3 mol·L-1·min-1
C. 2 min时,A的浓度为0.9mol·L-1D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
A.3mol C+1mol DB.1mol A+0.5mol B+1.5mol C+0.5mol D
C.1mol A+0.5mol B+1.5mol CD.4molA+2mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NOx、CO、SO2等大气污染气体的处理和利用是世界各国研究的热点问题。
(1)已知:
a.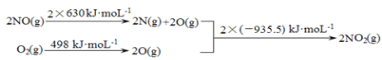
b.2NO(g)+O2(g)![]() 2NO2(g) ΔH1
2NO2(g) ΔH1
2SO2(g)+O2(g)![]() 2SO3(g) ΔH2=-196.6 kJ·mol-1
2SO3(g) ΔH2=-196.6 kJ·mol-1
①ΔH1 =___kJ·mol-1。
②写出NO2气体与SO2气体反应生成SO3气体和NO气体的热化学方程式____。
(2)煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
(资料:①反应Ⅰ和反应Ⅱ同时发生,②反应Ⅰ的速率大于反应Ⅱ的速率)
请回答下列问题:
①下列反应过程能量变化示意图正确的是____。
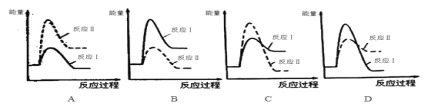
Ⅱ.可逆反应mA(g)+nB(g)![]() pC(g)+gD(g)的v—t图像如图甲所示,若其他条件不变,只在反应前加入合适的催化剂,其v-t图像如乙所示。下列说法正确的是___。
pC(g)+gD(g)的v—t图像如图甲所示,若其他条件不变,只在反应前加入合适的催化剂,其v-t图像如乙所示。下列说法正确的是___。
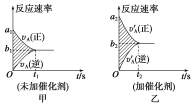
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图Ⅱ中阴影部分面积更大
Ⅲ.在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1____K2(填”>”“=“或”<”)。
②400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为____。当测得NH3、N2、H2的浓度分别为3molL1、2molL1、1molL1时,则该反应的v正(N2)___v逆(N2)(填”>”“=“或”<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、N2、H2的浓度分别为3molL1、2molL1、1molL1时,则该反应的v正(N2)___v逆(N2)(填”>”“=“或”<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应2A(g)+B(?)![]() 2C(g)达到化学平衡时:
2C(g)达到化学平衡时:
(1)升高温度时,C的量减少,则反应物的能量总和_____生成物的能量总和(填“>”、“<”或“=”)。
(2)如果增大压强,平衡向正反应方向移动,则B是_______态物质。
(3)若增加B的物质的量,平衡不移动,说明B是____________态物质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com