
【题目】电化学原理在化学工业中有广泛的应用。根据如下工作原理图,下列说法正确的是
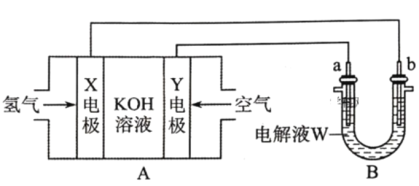
A.电极Y为正极,电极反应式为: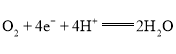
B.若W为饱和食盐水(滴有几滴酚酞溶液),则工作一段时间后a电极附近溶液变红
C.若a为粗铜(含Zn、Ag等杂质),W为CuSO4溶液,工作一段时间后![]() 减小
减小
D.若a为银棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.16g,则X电极消耗氢气0.224L
【答案】C
【解析】
由图可知,A装置为碱性氢氧燃料电池,X电极为负极,发生的电极反应式为:H2+2OH--2e-=2H2O,Y电极为正极,发生的电极反应式为:O2+2H2O+4e-=4OH-,总反应为:2H2+O2=2H2O;B装置为电解池,a为阳极,b为阴极,据此分析解答。
A.由分析可知,电极Y为正极,电极反应式为:O2+2H2O+4e-=4OH-,A错误;
B.a极为阳极,若W为饱和食盐水,有两种情况:若a极为活性电极如Cu,则a电极失电子变为相应的阳离子如Cu2+,若a为惰性电极,则电极反应式为:2Cl--2e-=Cl2↑,a极附近不显碱性,溶液不变红,B错误;
C.a为阳极,若a为粗铜(含Zn、Ag等杂质),则a极为Zn和Cu失电子变为Zn2+和Cu2+,b为阴极,Cu2+得电子变为Cu,根据得失电子守恒可知,a极补充的Cu2+小于b极消耗的Cu2+,即工作一段时间后,溶液中Cu2+浓度会减小,C正确;
D.没有给标准状况,无法计算X电极消耗氢气的体积,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)一种镍催化法生产GaN的工艺如图:
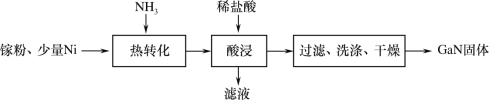
①镓(Ga)的原子结构示意图为![]() ,镓元素在周期表中的位置是___。
,镓元素在周期表中的位置是___。
②“热转化”时Ga转化为GaN的化学方程式是___。
③“酸浸”操作目的是___。
(2)某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
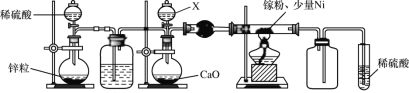
①仪器X中的试剂是__,加热前需先通入一段时间的H2,原因是__。
②取某GaN样品m克溶于足量热NaOH溶液,发生反应GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO3溶液将产生
GaO2-+NH3↑,用H3BO3溶液将产生![]() NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA
B.标准状况下,22.4L酒精含有的分子数为NA
C.在常温常压下,28gN2与CO混合物气体中所含的分子数目一定为NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )
A. 2:1:2 B. 1:1:2 C. 2:2:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密封容器中发生如下反应:xA(g)+yB(g)![]() nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
A.x+y<nB.该化学平衡向右移动
C.B的转化率增大D.A的物质的量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3的分解有催化作用:
O3+Cl === ClO+O2 ΔH1
ClO+O === Cl+O2 ΔH2
大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化如图:
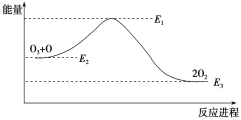
下列叙述中,正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. 2O2===O3+O 是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量/mol | 0.2 | 0.2 | 0 |
平衡物质的量/mol | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A.反应可表示为![]() ,其平衡常数为8 000
,其平衡常数为8 000
B.增大压强使平衡向生成Z的方向移动,则平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度,Z的浓度增大,则温度升高时![]() 正增大,
正增大,![]() 逆减小
逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,11.2L盐酸的原子总数为NA
B.常温常压下,14gN2含有的分子数为0.5NA
C.标准状况下,6.72L氖气中含有的分子数为0.3NA
D.常温常压下,9gH2O中含有的原子总数为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com