
【题目】某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列说法正确的是 ( )
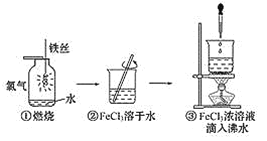
A.实验①、②所涉及的物质均为电解质
B.实验①、③发生的均为离子反应
C.实验②、③均未发生氧化还原反应
D.实验①、③反应制得的物质均为纯净物
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】CH4与CO2重整生成H2和CO的过程中主要发生下列反应
![]()
![]()
在恒压、反应物起始物质的量比![]() 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是

A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
(1)以上物质能导电的是_________________________。
(2)以上物质中属于非电解质的是_________________________。
(3)以上物质中溶于水后水溶液能导电的是_________________________。
(4)①、②在水溶液中反应的离子方程式为_________________________________。
(二)某溶液的溶质可能由下列离子组成:Cl-、![]() 、
、![]() 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有____________ (用离子符号表示,下同);一定没有______________;可能含有________________,检验是否存在该离子的方法为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)是制造LED的重要材料,被誉为“第三代半导体材料”。镓(31Ga)的氧化物和氢氧化物均为两性化合物,工业制备氮化镓的工艺流程如图所示。下列判断正确的是
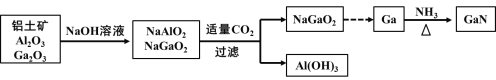
A.Ga位于第五周期第IIIA族B.酸性:Al(OH)3>Ga(OH)3
C.Ga(OH)3可与NaOH反应生成NaGaO2D.Ga与NH3反应的另一种生成物可用作航天燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:

(1)已知:CO(g) +H2O(g)CO2(g)+H2(g) H1=-41 kJ·mol-1
CH3CH2OH(g)+3H2O(g)2CO2(g)+6H2(g) H2 =+174.1 kJ·mol-1
反应I的热化学方程式为______。
(2)反应II在进气比[n(CO) : n(H2O)]不同时,测得相应的 CO 平衡转化率见下图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

①图中A、E和 G三点对应的反应温度TA、TE、TG的关系是_____,其原因是 ______。该温度下,要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是______。
②由图中可知CO的平衡转化率与进气比、反应温度之间的关系是____。
③A、B 两点对应的反应速率大小:vA_____vB(填“<” “=”或“>”)。已知反应速率 v=v正v逆= k正x(CO)x(H2O) k逆x(CO2) x(H2) ,k为反应速率常数,x为物质的量分数,在达到平衡状态为D点的反应过程中,当CO的转化率刚好达到20%时,![]() =_____。
=_____。
(3)反应III在饱和KHCO3电解液中,电解活化的CO2来制备乙醇,其原理如图所示,则阴极的电极反应式为___________。
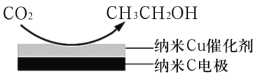
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
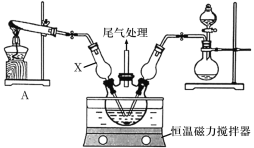
(1)仪器X的名称是______,其主要作用有导气、______。
(2)实验室利用装置A制NH3,发生反应的化学方程式为_______。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有_____。
(4)若体系中NH3过量会导致碱式氯化铜的产量___(填“偏高”、“偏低”或“无影响”),原因为___。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(5)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1。则称取的样品中 n(Cu2+)=_____mol。
(6)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂_____(填标号)。
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=_____mol。
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
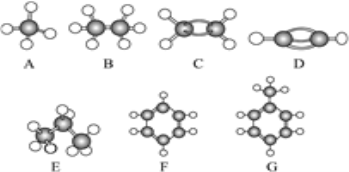
(1)常温下含碳量最高的气态烃是(填对应字母)__;
(2)能够发生加成反应的烃有(填数字)___种;
(3)一卤代物种类最多的是(填对应字母)__;
(4)写出D发生加聚反应的化学方程式:__;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用亚硫酸盐(X)吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数(δ)与溶液pH的变化关系如图所示。下列说法中不正确的是( )
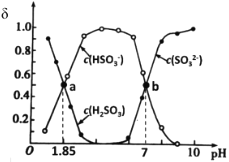
A.若X为(NH4)2SO3,图中b点溶液中n(HSO![]() )∶n(NH
)∶n(NH![]() )=1∶3
)=1∶3
B.若X为Na2SO3,当吸收液呈中性时:lgc(HSO![]() )-lgc(H2SO3)=5.15
)-lgc(H2SO3)=5.15
C.若X为(NH4)2SO3,(NH4)2SO3溶液呈碱性,说明水解程度:SO![]() >NH
>NH![]()
D.若X为Na2SO3,当吸收液pH=1.85时:c(Na+)=2c(HSO![]() )+c(SO
)+c(SO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com