
����Ŀ��H�Ǻϳɿ���ҩ��������ƵĹؼ��м��壬����һ�ֺϳ�·�����£�
(1)A�Ļ�ѧ����Ϊ___________��
(2)G�ķ���ʽΪ___________��H�й����ŵ�������___________��
(3)E�Ľṹ��ʽΪ___________����Ӧ�ڵķ�Ӧ����Ϊ___________��
(4)��Ӧ�Ļ�ѧ����ʽΪ___________��
(5)д��ͬʱ��������������F��ͬ���칹��Ľṹ��ʽ___________��
�����ܷ���ˮ�ⷴӦ������ʹ�
�����ܷ���������Ӧ
�����˴Ź���������5����ҷ����֮��Ϊ3��2��2��2��1
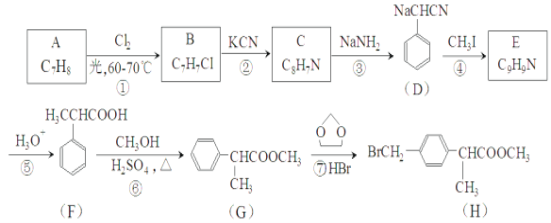
(6)����H�ĺϳ��ߣ����һ����![]() �ϳ�
�ϳ�![]() �ĺϳ�·��______��
�ĺϳ�·��______��
���𰸡��ױ� C10H12O2 ��ԭ�ӡ����� 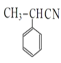 ȡ����Ӧ
ȡ����Ӧ  +HOCH3
+HOCH3![]()
![]() +H2O
+H2O 
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��������
��D�ṹ��ʽ֪��A�к��б��������A����ʽ֪��AΪ![]() ����B����ʽ��D�ṹ��ʽ֪��A��������ȡ����Ӧ����B��BΪ
����B����ʽ��D�ṹ��ʽ֪��A��������ȡ����Ӧ����B��BΪ![]() ��CΪ
��CΪ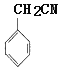 ����F�ṹ��ʽ֪����Ϊȡ����Ӧ��EΪ
����F�ṹ��ʽ֪����Ϊȡ����Ӧ��EΪ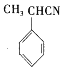 ��F����������Ӧ����G��G����ȡ����Ӧ����H��
��F����������Ӧ����G��G����ȡ����Ӧ����H��
(6)��![]() �ϳ�
�ϳ�![]() ��
��![]() ��
��![]() ��
��![]() ����������Ӧ�õ���
����������Ӧ�õ���![]() ������
������![]() ˮ��õ���
ˮ��õ���![]() ����
����![]() ��KCN��Ӧ�õ���
��KCN��Ӧ�õ���
(1) AΪ![]() ������Ϊ�ױ���
������Ϊ�ױ���
(2)G�Ľṹ��ʽΪ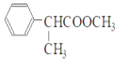 ������ʽΪC10H12O2��HΪ
������ʽΪC10H12O2��HΪ �������ŵ���������ԭ�ӡ�������
�������ŵ���������ԭ�ӡ�������
(3)�����Ϸ�����֪��E�Ľṹ��ʽΪ ��BΪ
��BΪ![]() ��CΪ
��CΪ ���ʷ�Ӧ��ΪE�е���ԭ�ӱ�-CNȡ���ķ�Ӧ����Ӧ����Ϊȡ����Ӧ��
���ʷ�Ӧ��ΪE�е���ԭ�ӱ�-CNȡ���ķ�Ӧ����Ӧ����Ϊȡ����Ӧ��
(4)��Ӧ����������Ӧ����ѧ����ʽΪ +HOCH3
+HOCH3![]()
![]() +H2O��
+H2O��
(5) �����ܷ���ˮ�ⷴӦ������ʹ���˵������������
�����ܷ���������Ӧ��˵������ȩ����
�����˴Ź���������5����ҷ����֮��Ϊ3��2��2��2��1��˵���ṹ�Գ����м�������������F��ͬ���칹��Ľṹ��ʽ![]() ��
��
(6) ��![]() �ϳ�
�ϳ�![]() ��
��![]() ����
����![]() ��
��![]() ����������Ӧ�õ���
����������Ӧ�õ���![]() ������
������![]() ˮ��õ���
ˮ��õ���![]() ����
����![]() ��KCN��Ӧ�õ���
��KCN��Ӧ�õ���![]() ������
������![]() �õ����ʺϳ�·��Ϊ
�õ����ʺϳ�·��Ϊ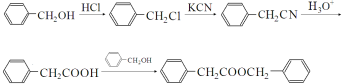 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ������Һ��һ���ܴ����������( )
A.![]() =1012����Һ�У�NH
=1012����Һ�У�NH![]() ��K+��HCO
��K+��HCO![]() ��NO
��NO![]()
B.c(OH-)=0.1mol/L����Һ�У�CO![]() ��Cl-��F-��K+
��Cl-��F-��K+
C.������Al3+����Һ�У�K+��Na+��SO![]() ��ClO-
��ClO-
D.���ȳʻ�ɫ����Һ�У�I-��Cl-��NO![]() ��Na+
��Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ij����̶����ܱ������м���2 mol A��1 mol B���������淴Ӧ![]() ������˵����ȷ����
������˵����ȷ����
A. ��������ѹǿ����ʱ˵����Ӧ�Ѵﵽƽ��
B. ����Ӧ�ﵽƽ��ʱ��c��A����c��B����c��C����2��1��3
C. ����Ӧ�ﵽƽ��ʱ�ų�����akJ
D. �����������䣬�����¶ȷ�Ӧ���ʼӿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ�(Cr)����Ȼ����Ҫ��+3�ۺ�+6�۴��ڡ�
��1��+6�۵�Cr������ϸ����ͻ��������岻���������������ƽ��仹ԭ�����ӷ�Ӧ����ʽΪ��3SO32��+Cr2O72��+8H+===2Cr3++3SO42��+4H2O���÷�Ӧ�������ͻ�ԭ�������ʵ���֮��Ϊ___________��
��2����ҵ�����ø�����( FeO. Cr2O3)ұ�����Ĺ���������ͼ��ʾ��
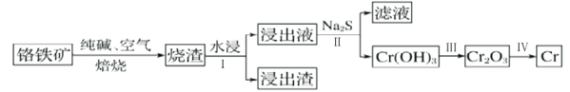
��Ϊ�ӿ챺�����ʺ����ԭ�ϵ������ʣ��ɲ�ȡ�Ĵ�ʩ֮һ��___________��
��ˮ����Ҫ��ý���Һ�IJ�����___________��
�۽���Һ����Ҫ�ɷ�ΪNa2CrO4������Na2S��Ӧ����Na2SO4���ɣ��������������Ӧ�����ӷ���ʽΪ___________��
��3��������Cr(OH)3���ܶȻ�Ksp=1��10��32����ҪʹCr3+��ȫ����pHΪ___________[c(Cr3+)����10��5mol��L��1����Ϊ��ȫ����]��
��4���Ը�����(Na2CrO4)Ϊԭ�ϣ��õ绯ѧ�����Ʊ��ظ�����(Na2Cr2O7)��ʵ��װ����ͼ��ʾ(��֪��2CrO42��+2H+=Cr2O72��+H2O)��
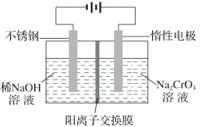
�������ĵ缫��ӦʽΪ___________��
�ڵ��һ��ʱ������������Һ��Na+���ʵ�����amol��Ϊbmol���������ظ����Ƶ����ʵ���Ϊ___________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯������������������з�������Ҫ�����á�
(1)�����������������Ͻ���� ____________��
A.�� B.��ͭ C.��ͭ D.ˮ��
(2)���ơ����������ֽ���Ԫ���У����������ǿ����______ �����γɵ����������������ͻ���ϵ���_______����ʢ����������Һ���Թ��еμӰ�ˮ����Ӧ�����ӷ���ʽΪ____________ ��
(3)��ͬѧΪ�˻�ó־ð�ɫ��Fe(OH)2������������ͼ��ʾװ�ã��ò���O2������ˮ���Ƶ�NaOH��Һ�����Ƶ�FeSO4��Һ��Ӧ����ò���O2������ˮ�ķ�����_________����Ӧ��ʼʱ����ֹˮ�е�Ŀ����____________��һ��ʱ��ر�ֹˮ�У����Թ�_______(����A������B��)�й۲쵽��ɫ��Fe(OH)2
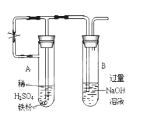
(4)��ʢ���Ȼ������Ȼ��������Ȼ�ͭ�����Һ���ձ��м������ۺ�ͭ�ۣ���Ӧ���������н�����������ֵ���______ ��
A.��ͭ���� B.������ͭ ���� C.����ͭ���� �� D.����ͭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ҫ��18mol/L Ũ��������100 mL 3.0mol/L ϡ���ᣬ��ش��������⣺
(1)����Ũ����������________����ȡŨ�������õ���Ͳ�Ĺ����_________(��ѡ�����)
A. 10mL B. 20mL C. 50mL D. 100mL
(2)ʵ���������Ϊ��
A.���Ƶõ���ҺС�ĵ�ת��������ƿ�С�
B.��ȡ����Ũ���� �����ձ���������������ˮ����ϡ�Ͳ���ȴ�����¡�
C.����������ƿ�м�����ˮ��Һ���̶�1��2cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ��ײ���̶������С�
D.����������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ע������ƿ����������
E.������ƿ�����������ҡ�ȡ�
�����������ȷ˳��Ϊ___________________(�����)��
(3)��������У���ʹ������ҺŨ��ƫ�ߵ���___________(�����)��
A.��ȡ����Ũ����ijͬѧ�۲�Һ��ʱ����
B.û�н��������IJ�������D
C.������ˮʱ�����������˿̶���
D.����ƿʹ��ǰ�ڱ�մ��ˮ��
E.����������ˮϴ����ȡŨ��������Ͳ��ϴ�ӵ�Һ��ע������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ǧ![]() �������Ժϳ���֬Ϳ�ϡ�ӡˢ��ī��ˮ�ʺ��Ͳʵ����ϣ�ɫֽ����������Ʒ����ɫ����
�������Ժϳ���֬Ϳ�ϡ�ӡˢ��ī��ˮ�ʺ��Ͳʵ����ϣ�ɫֽ����������Ʒ����ɫ����
(1)![]() ��Cr�Ļ��ϼ�Ϊ________________��
��Cr�Ļ��ϼ�Ϊ________________��
(2)����Ǧ����ˮ�ʺ��Ͳʵ���ɫ���ϡ����������е�������ɫ���ڣ�![]() ��ƽ�ⳣ��
��ƽ�ⳣ��![]() ________________��
________________��![]()
(3)����![]() ����Ҫ��
����Ҫ��![]() ��ʽ���ڣ�ͬʱ����
��ʽ���ڣ�ͬʱ����![]() ��
��![]() ������
������![]() �Ǹ���ƹ����в����ĺ������࣬ʵ�����ۺ����ã��ɼ��ٸ��Ļ�����Ⱦ�������ۺ����ù����������£�
�Ǹ���ƹ����в����ĺ������࣬ʵ�����ۺ����ã��ɼ��ٸ��Ļ�����Ⱦ�������ۺ����ù����������£�
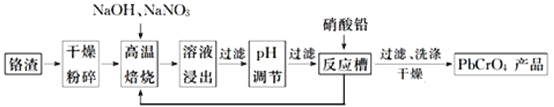
��ش��������⣺
![]() �������±���ǰ�����Ŀ����_____________________________��
�������±���ǰ�����Ŀ����_____________________________��
![]() ���±��յõ��IJ��ﺬ��
���±��յõ��IJ��ﺬ��![]() ��һ������Ⱦ�����壬���������ͻ�ԭ�����ʵ���֮��Ϊ________________��
��һ������Ⱦ�����壬���������ͻ�ԭ�����ʵ���֮��Ϊ________________��
![]() ���±���ʱ
���±���ʱ![]() �μӷ�Ӧ�Ļ�ѧ����ʽΪ________________________��
�μӷ�Ӧ�Ļ�ѧ����ʽΪ________________________��
![]() ��ȥ����Һ�е�������ü���________
��ȥ����Һ�е�������ü���________![]() ���Լ�����
���Լ�����![]() ������pH����ȥ��Ԫ�ص����ӷ���ʽΪ___________________________________________��
������pH����ȥ��Ԫ�ص����ӷ���ʽΪ___________________________________________��
![]() ��ͨ���������̴���
��ͨ���������̴���![]() �ĸ������õ�
�ĸ������õ�![]() ��Ʒ
��Ʒ![]() ���������
���������![]() ������������________
������������________![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�����Դ��õIJ���������ͼ��ʾ������˵����ȷ���ǣ�������
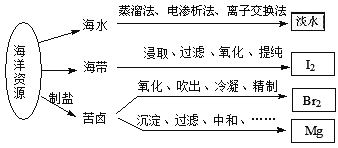
A. �Ӻ�ˮ�л�ȡ��ˮ����ʷ��õķ��������ӽ�����
B. ʵ�����дӺ����л��I2����Ҫ�õ�����Ҫ������������©�����ձ�����Һ©����
C. ��SO2��Һ���մӿ�±�д����ĵ�����ʱ�����������ӷ�Ӧ��Br2+SO2+2H2O�T4H++SO42��+2Br��
D. ��ʯ��ʯ������ȴӿ�±����ȡþʱ��������Ӧ�ķ�Ӧ�����л��ϡ��ֽ⡢�û����ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϡ���з����ߵ�Ԫ�أ����ڵ��Ӳ��ϡ������ȷ����Ӧ�ù㷺�����Է�̼���(��CeFCO3��BaO��SiO2��)Ϊԭ���Ʊ�������(CeO2)�����ⶨ�䴿�ȡ��乤���������£�

��֪����ϡ��������SO![]() �γɸ��γ�����
�γɸ��γ�����
Ce2(SO4)3��Na2SO4��nH2O==== Ce2(SO4)3��Na2SO4��nH2O��(�����)��
�����壺һ���л���ṹ��ʽΪ![]() �������������ױ�����Ϊ(SCN2H3)2��
�������������ױ�����Ϊ(SCN2H3)2��
��Ce3���ڿ������ױ�����ΪCe4����
�ش��������⣺
(1)����ʱ��Ϊ����߱���Ч�ʣ��ɲ�ȡ�Ĵ�ʩ��________________________________________
(2)CeFCO3��CeԪ�صĻ��ϼ�Ϊ___________������A����Ҫ�ɷ���_____________
(3)���պ�������������ϡ���Ľ����ʺ�����Ũ�ȡ��¶��йأ���ͼ��ʾ��Ӧѡ������˵�����Ϊ___________������Ũ�ȹ���ʱ�������ʼ�С��ԭ����__________��
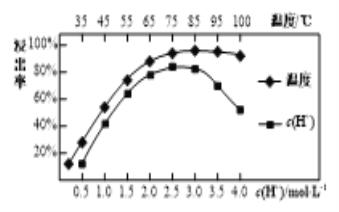
(4)���������Ŀ���ǽ�Ce4����ԭΪCe3������Ӧ�Ļ�ѧ����ʽΪ_________��
(5)����ۼ��������ͨ���������H2O2������ҪĿ��Ϊ_________��
(6)����ܵ����ӷ���ʽΪ________________________��
(7)ȡ���ò�ƷCeO2 8.0g����30 mL�������20 mL������Һ�����ܽ⣬��ȴ�����º����250 mL��Һ��ȡ25.00 mL��Һ��0.2000 mol��L��1���������[(NH4)2Fe(SO4)2]��Һ�ζ�����֪�ζ�ʱ�����ķ�ӦΪFe2����Ce4��==== Fe3����Ce3�����ﵽ�ζ��յ�ʱ���������������Һ20.50 mL����ò�Ʒ�Ĵ���Ϊ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com