
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、NH4+、Mg2+、Cl-、K+ |
| B、Fe2+、Na+、Cl-、I- |
| C、SO42-、HCO3-、Cl-、K+ |
| D、AlO2-、Na+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(2)(4)(3)(2) |
| B、(4)(2)(3)(2)(1) |
| C、(1)(2)(3)(2)(4) |
| D、(4)(2)(1)(2)(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
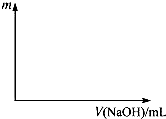 将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.
将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com