
【题目】下列物质中既有有离子键又有共价键的是( )
A.Na2S
B.NaCl
C.Na2O2
D.BaCl2
科目:高中化学 来源: 题型:
【题目】一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电氟镁动力电池比锂电池具有更高的能量密度和安全性,在充电和放电时,其电池反应为Mg+2MnF3![]() 2MnF2+MgF2。下列说法不正确的是( )
2MnF2+MgF2。下列说法不正确的是( )
A. 放电时,镁为负极材料
B. 放电时,电子从镁极流出,经电解质流向正极
C. 充电时,阳极的电极反应式为:MnF2+F--e-=MnF3
D. 充电时,外加直流电源负极应与原电池的Mg极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度(t℃)时,水的Kw=10-13,则该温度(填 “大于”“小于”或“等于”)_________ 25℃,理由是_________,将此温度下pH =11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合液为中性,则a∶b_________;
(2)若所得混合液的pH=2,则a∶b_________。
Ⅱ.25℃时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是(_____)
A.该溶液pH=4 B.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
C.此酸的电离平衡常数约为1×10-7 D.升高温度,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于一个反应可以从多个角度认识。下列关于盐酸与NaOH溶液反应的说法不正确的是
A.属于复分解反应B.属于离子反应
C.属于中和反应D.属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元索的单质和化合物在生产生活中有重要的用途。
(1)基态溴原子的核外电子排布式为[Ar]_________。
(2)在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是_________。
(3)HIO3的酸性_________(填“强于”或“弱于”)HIO4,原因是_________。
(4)ClO2-中心氯原子的杂化类型为_________,ClO3-的空间构型为_________。
(5)晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(![]() ,
, ![]() ,0);C处为(1,1,1)。则D处微粒的坐标参数为_________。
,0);C处为(1,1,1)。则D处微粒的坐标参数为_________。
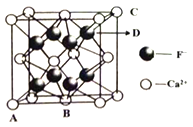
②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3,则晶胞中Ca2+与离它最近的F-之间的距离为_________nm(设NA为阿伏加德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com