
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v(NH3)=0.05 mol/(Lmin)B.v(NH3)=0.2 mol/(Lmin)
C.v(H2)=0.3 mol/(Lmin)D.v(H2)=0.4 mol/(Lmin)
【答案】D
【解析】
同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项。
反应为N2(g)+3H2(g)![]() 2NH3(g),以N2的反应速率为标准进行判断。
2NH3(g),以N2的反应速率为标准进行判断。
A.v(NH3)=0.05 mol/(Lmin),所以v(N2)=0.025 mol/(Lmin);
B.v(NH3)=0.2 mol/(Lmin),所以v(N2)=0.1 mol/(Lmin);
C.v(H2)=0.3 mol/(Lmin),所以v(N2)=0.1 mol/(Lmin);
D.v(H2)=0.4 mol/(Lmin),所以v(N2)=![]() mol/(Lmin)>0.1 mol/(Lmin),所以反应速率最快的是
mol/(Lmin)>0.1 mol/(Lmin),所以反应速率最快的是![]() mol/(Lmin),故合理选项是D。
mol/(Lmin),故合理选项是D。


科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼酸(H3BO3)在水中电离出阴离子B(OH)4-,请试着写出硼酸的电离方程式___________。
(2)已知:H3BO3的电离常数Ka=5.8×1010,H2S的电离常数掏Ka1=5.7×108、Ka2=1.2×1015,向饱和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,写出发生反应的离子方程式_________。
(3)BCl3主要用作半导体硅的掺杂源,遇水强烈水解,0.01mol BCl3溶于300mL蒸馏水中(溶液体积变化忽略不计),则所得溶液的pH值约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S→TiO2/S*(激发态)
TiO2/S*→TiO2/S*+e-
I3-+2e-→3I-
2TiO2/S++3I-→2TiO2/S+I3-
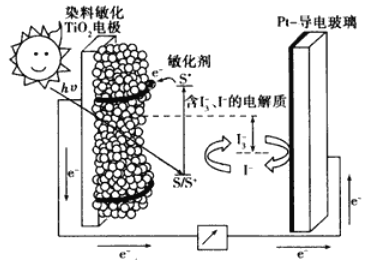
下列关于该电池叙述错误的是
A. 电池工作时,是将太阳能转化为电能
B. 电池工作时,I-离子在镀铂导电玻璃电极上放电
C. 电池中镀铂导电玻璃为正极
D. 电池的电解质溶液中I-和I3-的浓度不会减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
Ⅰ.(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_____(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
Ⅱ.白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c 取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d 重复滴定实验3次并记录数据。
e 计算白醋样品中醋酸总酸度。回答下列问题:
(2)实验a中量取20.00 mL白醋所用的仪器名称是___________。
(3)若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_________(填“偏大”、“偏小”或“不变”)。
(4)实验C中判断滴定终点的现象是_______。
(5)实验数据如下表,则该白醋样品中醋酸总酸度为_________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
Ⅲ.25℃,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如下图所示。
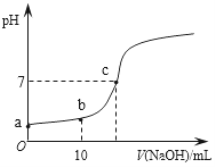
(6)a点溶液pH > 1,用电离方程式解释原因:_____________。
(7)下列有关b点溶液的说法正确的是_______(填字母序号)。
a 溶质为:CH3COOH、CH3COONa
b 微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c 微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d 微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(8)c点溶液中离子浓度的大小顺序:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25°C时,向amL0.10mol·L-1的HNO2溶液中逐滴加入0.10mol·L-1的NaOH溶液。滴定过程中混合溶液的pOH[pOH=-lgc(OH-)]与NaOH溶液的体积V的关系如图所示。已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),下列说法不正确的是( )
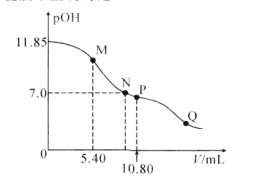
A.25°C时,HNO2电离常数的数量级是10-4
B.M点溶液中存在:2c(H+)+c(HNO2)=c(OH-)+c(NO2-)
C.图上M、N、P、Q四点溶液中所含离子的种类相同
D.a=10.80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
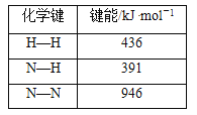
下列说法正确的是( )
A.该反应为吸热反应
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=92 kJ·mol-1
D.生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是
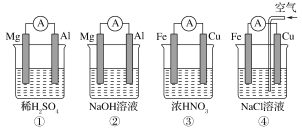
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,正极反应式为6H2O+6e-==6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-==Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-==H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,某科研小组设计如下工艺流程回收铜并制取胆矾(流程中RH为萃取剂),下列说法正确的是
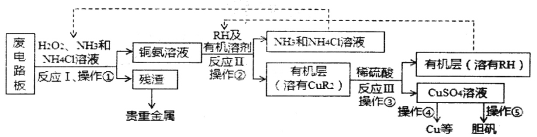
A.反应I的离子方程式为:Cu+H2O+2NH3+2NH4+==Cu(NH3)42++2H2O
B.操作②用到的主要仪器为蒸馏烧瓶
C.操作④以石墨为电极电解硫酸铜溶液:阳极产物为O2和H2SO4
D.操作⑤为:蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com