
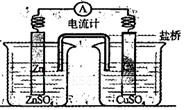
| A.铜是阳极,铜片上有气泡产生 |
| B.铜离子在铜片表面被氧化 |
| C.电子从锌片经外电路流向铜片 |
| D.正极附近的SO42-离子浓度逐渐增大 |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
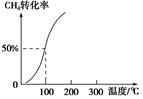
 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。| A.c(H2)减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c(H2)/c(CH3OH)减小 |
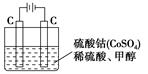
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
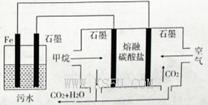
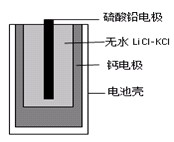
A.铁电极的电极反应式为: |
B.通人空气的石墨电极的电极反应式为 |
| C.若左池石墨电极产生44. 8L(标准状况)气体,则消耗氧气0. 5mol |
| D.为增强污水的导电能力,可向污水中加入适量工业用食盐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.I2+2Rb++2e-=2RbI |
| B.I2+2Ag++2e-=2AgI |
| C.Ag-e-=Ag+ |
| D.4AlI3+3O2=2Al2O3+6I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
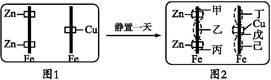
| A.甲区呈现蓝色 | B.乙区呈现红色 |
| C.戊区产生Cu2+离子 | D.丁区产生Fe3+离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
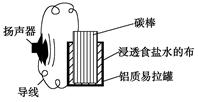
| A.碳棒上发生的主要反应为:2H++2e-=H2↑ |
| B.铝质易拉罐将逐渐得到保护 |
| C.电池总反应为:4Al+3O2+6H2O==4Al(OH)3 |
| D.电子方向为:铝质易拉罐→导线→扬声器→导线→碳棒→浸透食盐水的布 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
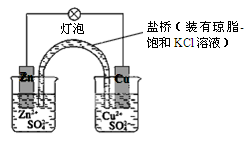
| A.正极反应为Zn-2e-=Zn2+ |
| B.电池反应为Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.取下盐桥,原电池仍可工作 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com