
【题目】将下列溶液加热蒸干灼烧,最后所得的固体为原溶质的是 ( )
A. NaClOB. KMnO4C. FeSO4D. Na2CO3
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】
深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
请回答下列问题:
(1)①Fe2+基态核外电子排布式为_____。
②![]() 的空间构型为______(用文字描述)。
的空间构型为______(用文字描述)。
③(CN)2分子中碳原子杂化轨道类型为_______,一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
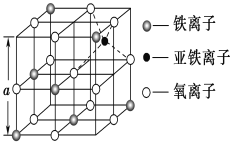
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2 molL-1
B. 配制200 mL 4.6 molL-1的稀硫酸需取该硫酸25 mL
C. 该硫酸与等体积的水混合后所得溶液浓度为9.2 molL-1
D. 该硫酸与等体积水混合后质量分数大于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为氯气与金属钠反应设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
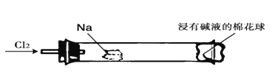
A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________;
③该反应的平衡常数表达式为K=___________。
④已知:K(300℃)>K(350℃),该反应是________(选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______(填“增大”、“减小”或“不变”)。

(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,在20 mL 0.1 mol·L-1氨水溶液中逐滴加入0.1 mol·L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是 ( )
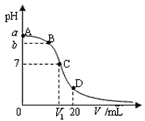
A. 当V=10mL时,溶液中存在: c(H+)+c(NH4+)=c(NH3·H2O)+c(OH-)
B. A、C间任一点,溶液可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. 在C点,V1<10mL,且有 c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D. 在D点,存在:c(NH4+)+c(NH3·H2O)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示。下列说法正确的是

A. 溶解度S(FeS)<S(ZnS)
B. a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-)
C. 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液
D. 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
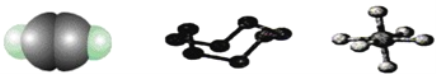
A. 32 g S8分子中含有0.125 mol σ键
B. SF6是由极性键构成的分子
C. 1 mol C2H2分子中有3 mol σ键和2 mol π键
D. S8中S的杂化方式为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com