
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
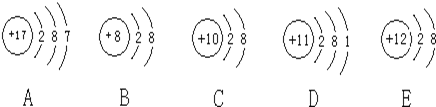
(1)属于离子结构示意图的是______、______(填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同)______,最容易失去电子的原子是______,最容易得到电子的原子是______。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式______。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______、______。
【答案】B E C D A NaCl=Na++Cl- Na+ Al3+
【解析】
质子数与核外电子数相等为原子,质子数与核外电子数不相等的为离子,金属元素的原子易失去电子,非金属元素的原子易得到电子;周期表中上周期右边的元素形成的离子与下周期左边的元素形成的离子具有相同的核外电子排布,据此解答。
根据结构示意图可知A是氯原子,B是氧离子,C是氖原子,D是钠原子,E是镁离子。则
(1)结构示意图中质子数与核外电子数不相等的是离子,故答案为B、E;
(2)稀有气体元素最外层已达到稳定结构,性质最稳定;金属元素的原子易失去电子,非金属元素的原子易得到电子,5种粒子中D为Na,易失电子,A为Cl原子,则Cl原子最容易得电子,故答案为C、D、A;
(3)A、D两种元素形成的化合物为NaCl,NaCl在水溶液中电离出钠离子和氯离子,电离方程式为NaCl=Na++Cl-;
(4)最外层有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子,故答案为Na+、Al3+、F-等。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应:NO2(g)+ SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到反应限度的是
SO3(g)+NO(g),下列能说明反应达到反应限度的是
A. 体系压强保持不变B. 混合气体颜色保持不变
C. SO3和NO的体积比保持不变D. 每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为__________________。
(2)由A、B、C三种元素形成的化合物的电子式为___________,这种化合物形成的晶体中所含的化学键类型有______________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为_____________________________________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是___________________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___。
(2)1.00L 1.00mol/LH2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为___。
(3)已知反应CH3-CH3→CH2=CH2(g)+H2(g),有关化学键的键能如下:
化学键 | C-H | C=C | C-C | H-H |
键能E/kJ/mol | 414.4 | 615.3 | 347.4 | 435.3 |
通过计算得出该反应的反应热为_______________。
(4)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和H2O(g)时,放出33.4kJ的热量,则该反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年,居里夫妇![]() 粒子(4He)轰击27Al得到一种自然界中不存在的磷元素的一种核素(
粒子(4He)轰击27Al得到一种自然界中不存在的磷元素的一种核素(![]() ):
):![]() +
+![]()
![]()
![]() +
+![]() ,开创了人造核素的先河。
,开创了人造核素的先河。
(1)下列有关说法正确的有______(填序号)。
A. ![]() 的质子数是27 B.
的质子数是27 B. ![]() 是一种电中性粒子
是一种电中性粒子
C. ![]() 和
和![]() 互为同位素 D. P元素的相对原子质量为30
互为同位素 D. P元素的相对原子质量为30
(2)元素的化学性质主要取决于______(填序号)。
A. 原子最外层电子数 B. 原子核内中子数
C. 原子核内质子数 D. 原子质量数
(3)不同种元素的本质区别是______(填序号)。
A. 原子的质子数不同 B. 原子的中子教不同
C. 原子的最外层电子数不同 D. 原子的质量数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离乙醇、乙酸操作正确的是

a | b | c | d | |
A | Na2CO3饱和溶液 | 乙酸钠 | 硫酸 | 蒸馏 |
B | Na2CO3固体 | 乙酸钠 | 盐酸 | 过滤 |
C | CaO固体 | 乙酸钙 | 硫酸 | 蒸馏 |
D | CaO固体 | 乙酸钙 | 盐酸 | 蒸馏 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中医药科技创新和人类健康事业作出巨大贡献。我国化学家在确认青蒿素分子结构之后实现了青蒿素的全合成。根据信息(部分条件和步骤已省略)回答下列问题:
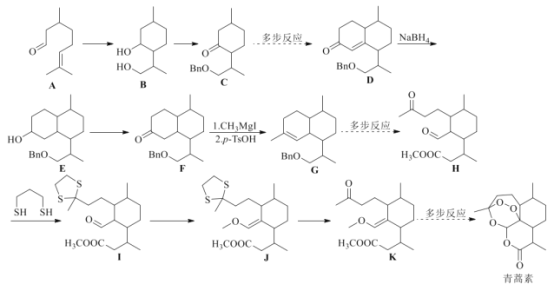
已知:![]() ,按要求回答下列问题:
,按要求回答下列问题:
(1)B的分子式为________________,所含官能团名称为________________________。![]() 的反应类型为________________。
的反应类型为________________。
(2)A的同系物中含碳原子数目最少的物质的结构简式为________________。A的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有________种,其中核磁共振氢谱峰数最少的物质的结构简式为________________。
(3)写出A与银氨溶液反应的化学方程式________________________________。
(4)通过![]() 的反应,分子中引入了硫醚基团,而
的反应,分子中引入了硫醚基团,而![]()
![]() 的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
(5)根据青蒿素所含官能团,推测其可能具有的性质________。
a.具有氧化性 b.可发生水解反应 c.易溶于水
(6)参照上述合成路线,写出以![]() 为主要原料,经四步反应制备
为主要原料,经四步反应制备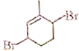 的流程。_____________
的流程。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
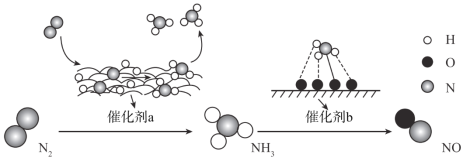
下列叙述正确的是
A.N2![]() NH3,NH3
NH3,NH3![]() NO均属于氮的固定
NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com