
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。

(1)步骤1的主要操作是__________,需用到的玻璃仪器除烧杯、玻璃棒外有________。
(2)步骤2中发生反应的化学方程式为___________________________
(3)步骤3中发生反应的化学方程式为___________________________
(4)步骤4中涉及的操作是:蒸发浓缩、_________、过滤、洗涤、烘干。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某工厂排放的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性小组利用这种废液来制取较纯净的氯化钾晶体及液溴,他们设计了如下的流程(提示:图中试剂a的作用是将Br-转化为Br2)
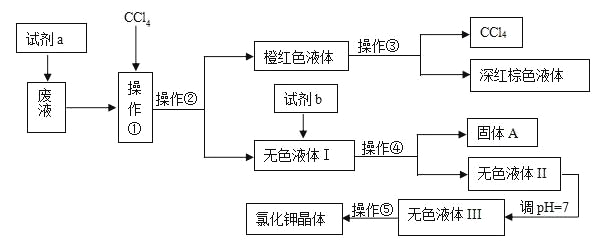
试剂b需要从以下试剂中选择:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸
(1)操作①②③④⑤的名称是________(填序号)。
A. 萃取、过滤、分液、过滤、蒸发结晶
B. 萃取、分液、蒸馏、过滤、蒸发结晶
C. 分液、萃取、过滤、过滤、蒸发结晶
D. 萃取、分液、分液、过滤、蒸发结晶
(2)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是_____________________________________________________________。
(3)调节pH=7的作用是________________________________________,所用的试剂是___________(填名称)
(4)操作⑤中用到的瓷质仪器名称是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨与水的电离相似,存在着微弱的电离:2NH3![]()
![]() +
+![]() 。对该体系的说法中错误的是
。对该体系的说法中错误的是
A. 液氨中含有NH3、![]() 和
和![]() 等微粒
等微粒
B. 一定温度下,液氨中c(![]() )与c(
)与c(![]() )的乘积为一常数
)的乘积为一常数
C. 液氨的电离达到平衡时,c(NH3)=c(![]() )=c(
)=c(![]() )
)
D. 只要不加入其他物质,液氨中c(![]() )总是与c(
)总是与c(![]() )相等
)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:
盐碱地产生碱性的原因:__________________________________________;
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(5)已知:常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;则 NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验是化学研究的一种重要手段,现有下图所示A-G七种仪器,请根据要求填空。
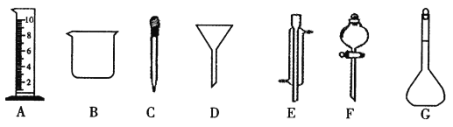
(1)写出仪器名称:E_____________,F_____________。
(2)上述仪器中实验之前需检查装置是否会漏水的是______________(填仪对应字母)。
(3)下列实验操作中用到仪器D的是_________(选填下列选项的编号字母 )。
A.分离水和CCl4的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物
Ⅱ.某课外兴趣小组需要200 mL1 mol/L的Na2CO3溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
应称取Na2CO3的质量______(g) | 应选用容量瓶的规格 _______(mL) | 除容量瓶外还需要的其它玻璃仪器是上图中的量筒、烧杯、_____(填仪器名称)及玻璃棒 |
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)______________。
A.将已冷却的溶液沿玻璃棒注入容量瓶中
B.用托盘天平准确称量所需Na2CO3的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C.用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
D.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E.将容量瓶盖紧,振荡,摇匀
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响 (填“偏高”、“偏低”或“无影响”)?
没有进行C操作________;配制溶液时,容量瓶未干燥_________;定容时俯视刻度线_________。
(4)在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cl2 + SO2 + 2H2O = 2HCl + H2SO4的反应中:
(1)氧化剂是______________,还原剂是__________________,
(2)若反应消耗7.1g Cl2,同时消耗标准状况下SO2的体积约为____________L,反应生成H2SO4物质的量是___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定100mL浓度均为0.1mol·L-1 的三种酸(HM、HN和HR) 溶液,滴定的曲线如图所示,下列判断错误的是( )
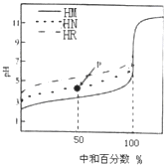
A. 三种酸的电离常数关系: KHR>KHN>KHM
B. pH=7时,三种溶液中:c (M-) >c (N-)>c (R-)
C. 滴定至P点时,溶液中:c (Na+) >c (N-) >c (HN) >c (H+) >c (OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR) =c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.15 g金属钠跟水反应后,得到100 mL溶液,试计算:
生成的气体在标准状况下是多少毫升?
_________________
反应后所得溶液的物质的量浓度是多少?
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 质量相等的O2和O3中所含原子数相等
B. 物质的量相等的O2和O3中含分子数相等
C. 质量相等的CO和CO2中所含碳原子数相等
D. 物质的量相等的CO和CO2中含碳原子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com