
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
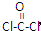 ,COCl2分子内含有
,COCl2分子内含有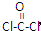 中含有3个σ键1个π键,
中含有3个σ键1个π键,

科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
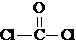 ,②COCl2分子内含有
,②COCl2分子内含有查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?漳州二模)[化学---物质结构与性质]研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
(2010?漳州二模)[化学---物质结构与性质]研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省三明一中高二下学期第一次月考化学试卷(带解析) 题型:填空题
(8分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是__________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:______________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4[来源:学科网ZXXK] |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com