
���й��ڵ������Һ��������ȷ����
| A�������£�Na2CO3��Һ��pH>7 |
| B��0.1mol/L Na2CO3��Һ��35��ʱ���Ա�25��ǿ��˵����ˮ�ⷴӦ���Ƿ��ȷ�Ӧ |
| C�������£�pH=7��NH4Cl�백ˮ�Ļ����Һ�и�����Ũ�ȵĹ�ϵΪ�� c(Cl-)=c(NH4+)>c(H+)=c(OHһ) |
| D�������£��к�pH���������ͬ������ʹ��ᣬ����NaOH�����ʵ�����ͬ |
AC
�������������A������CO32-����ˮ�⣺CO32��+H2O HCO3��+OH������Һ�Լ��ԣ���ȷ��B��˵��ˮ�������ȵģ�����C��NH4Cl��ȫ����ΪNH4+��Cl-���������İ�ˮ����NH4+��ˮ�⣬�ɵ���غ�ʽ�� c(NH4+)+c(H+)=c(OHһ) +c(Cl-)���οɵã�c(Cl-)=c(NH4+)>c(H+)=c(OHһ)����ȷ��D�����������ᣬ���ֵ��룬pH��ͬ��������������Ǵ���Ũ��Զ�������ᣬ�����ͬʱ����NaOH�Ǵ���Զ�������ᣬ����
HCO3��+OH������Һ�Լ��ԣ���ȷ��B��˵��ˮ�������ȵģ�����C��NH4Cl��ȫ����ΪNH4+��Cl-���������İ�ˮ����NH4+��ˮ�⣬�ɵ���غ�ʽ�� c(NH4+)+c(H+)=c(OHһ) +c(Cl-)���οɵã�c(Cl-)=c(NH4+)>c(H+)=c(OHһ)����ȷ��D�����������ᣬ���ֵ��룬pH��ͬ��������������Ǵ���Ũ��Զ�������ᣬ�����ͬʱ����NaOH�Ǵ���Զ�������ᣬ����
���㣺������Һ�е�����ƽ�⣬�����漰��ˮ���Լ��ԡ�ˮ�����ȡ�����Ũ�ȴ�С�Ƚϡ�����к������������⡣


 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�ȡ0.3 mol/L HY��Һ��0.3 mol/L NaOH��Һ�������ϣ����ƻ�Ϻ���Һ����仯������û����Һ��pH=9��������˵�������ϵʽ����ȷ����
| A�������Һ����ˮ���������c(OH-)=1��10-9 mol/L |
| B�������Һ������Ũ�ȴ�С����Ϊ��c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C��c(OH-)=c(HY)=c(H+)=1��10-9 mol/L |
| D��c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ȷ����(��NAΪ�����ӵ���������ֵ)
| A��������Һ���Ƿ���Fe2+�ķ������ȵμ���ˮ���ٵμ�KSCN��Һ |
| B��Ǧ���طŵ�ʱ�ĸ�����ӦʽΪ��PbO2+4H��+SO42һ+2eһ��PbSO4+2H2O |
| C��Na2CO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ���Һ��pH��Kw����С |
| D��ij��ص��ܷ�ӦΪ��5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl��ÿ����lmolNa2Mn5O10ת�Ƶ�����2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��������������� (����)
| A����a L 0.1 mol/L ��CH3COOH��Һ��b L 0.1 mol/L�� KOH��Һ��ϣ������� Һ��һ�����ڣ�c (K+)+ c (H+) =" c" (CH3COO��) + c (OH��) |
| B����ˮ�У�c(Cl��)��c(H+)��c(OH��)��c(ClO��) |
| C����0.1 mol/L ��NaHCO3��Һ��0.3 mol/L ��Ba(OH)2��Һ�������ϣ������� Һ��һ�����ڣ�c (OH��) >c (Ba2+)>c (Na+)> c (H��) |
| D�������£���pH=3��CH3COOH��Һ��pH=11��NaOH��Һ�У�ˮ�ĵ���̶���ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ȷ����
A����֪I3�� I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
B����������10mL pH =3�Ĵ�����Һ�м�ˮϡ�ͺ�,��Һ�� ��С ��С |
| C������ʱka(HF)��3.6��10��4��ka(CH3COOH)��1.75��10��5��0.1 mol /L��NaF��Һ��0.1 mol /L��CH3COOK��Һ���,һ����c(Na��) ��c(F��)��c(K��)��c(CH3COO��)���� |
D����25��ʱ����amol/L�İ�ˮ��0.01 mol/L������������ϣ���ַ�Ӧ����Һ��c(NH4��)��c(Cl��)����25��ʱNH3 ? H2O�ĵ��볣��Kb��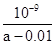 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����й�����Ũ�ȹ�ϵ�������У���ȷ����
| A��25��ʱ��NaB��Һ��pH��8��c(Na��)��c(B��)��9.9��10��7mol��L��1 |
| B��25��ʱ����0.1mol��L��1NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ� c(Na��)��c(NH4+)��c(SO42��)��c(OH��)��c(H��) |
| C��0.1mol��L��1��NaHCO3��Һ�У�c(OH��)��2c(CO32��)��c(H+)��c(H2CO3) |
| D��ͬ���£�pH��ͬʱ����Һ���ʵ���Ũ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ���й�����ĵ���ƽ�ⳣ�����£������й�˵����ȷ����
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ����25�棩 | 1.8��10��5 | 4.9��10��10 | K1=4.3��10��7 K2=5.6��10��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������Һ�и�����Ũ�ȹ�ϵ����ȷ����
| A��0.1 mol/LCH3COOH��Һ�У�c(CH3COO��)+ c(CH3COOH)=0.1mol/L |
| B��NaHCO3��Һ�У� c(OH��) = c(H��) + c(H2CO3)��c(CO32��) |
| C��CH3COONa��Һ�У�c(Na��)> c(CH3COO��)> c(OH��)> c(H��) |
| D��Na2S��Һ�У�2 c(Na+��= c(S2��) + c(HS��)+ c(H2S) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£����������������
A����0.1mol��L-1�Ĵ�����Һ�м�ˮ��ͨ��HCl���嶼��ʹ ֵ���� ֵ���� |
| B��0.1mol��L-1�Ĵ�������Һ20mL��0.1mol��L-1����10mL��Ϻ���Һ�����ԣ�����c(CH3COO��)��c(Cl��)��c(H��)��c(CH3COOH) |
| C��pH=4�Ĵ�����pH=10������������Һ�������ϣ�������ҺpH��7 |
D��0.1mol��L-1ijһԪ��HA��Һ�� =1��10��8�������Һ����ˮ�������c(H��)��1��10��11mol/L =1��10��8�������Һ����ˮ�������c(H��)��1��10��11mol/L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com