



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
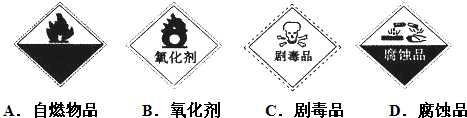
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| A����Ϊ������H2SO4Ϊ���Һ |
| B����Ϊ������ŨNaOHΪ���Һ |
| C�����������ĵ缫��ӦΪFe+8OH--6e-�T4H2O+FeO42- |
| D����ʧȥ3 mol���ӿ����������õ�33.6 L���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
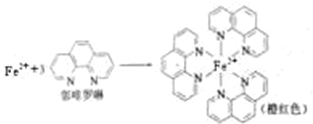
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��I2�������� |
| B��H2O2����������������ԭ�� |
| C��������ǿ��˳��ΪH2O2��I2 |
| D������1 mol I2ʱת��2 mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������Ե��� |
| B�������ǻ���� |
| C���������Ӵ�С��1��100nm֮�� |
| D����ɢ��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1 mol R��g���������ܺʹ���1 mol M��s����1 mol N��g�� �������ܺ� | ||
| B����2 mol R ��g����1 mol N��g���ڸ������³�ַ�Ӧ���ų�����Q2 kJ | ||
C����1 mol M��s�� ��N��g����ȫת��ΪT ��g��ʱ���ٶ���������ʧ�����ų�����Q1+
| ||
| D��M��g��+N��g��?R��g����H=-Q3 kJ?mol-1����Q3��Q1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��������Ϊ16����ԭ�ӣ�
| ||||
| B������Ļ�ѧʽ��NaHCO3 | ||||
C��Mg2+�ṹʾ��ͼ��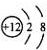 | ||||
D����˿��������ȼ�յĻ�ѧ����ʽ��Fe+Cl2
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com